Введение
Лейомиома матки — доброкачественная моноклональная опухоль, происходящая из гладкомышечных клеток шейки или тела матки1. Лейомиома матки на сегодняшний день является одной из значимых проблем в акушерстве и гинекологии, в структуре гинекологической патологии это наиболее встречающееся доброкачественное новообразование [1]. Заболевание может существенно ухудшать качество жизни пациенток и отрицательно влиять на их репродуктивные планы. Поэтому в случае необходимости сохранения фертильности следует придерживаться органосохраняющей тактики лечения. Большое признание в лечении данной патологии получила миомэктомия1. Однако существуют риски возникновения осложнений во время беременности и в родах, таких как образование рубца на матке и в дальнейшем ее разрыв. С появлением лапароскопической миомэктомии и совершенствованием как технического оснащения, так и хирургических навыков значительно снизилось количество осложнений, но, несмотря на это, данная проблема не утратила свою актуальность [2].
Рутинным методом диагностики является ультразвуковое исследование (УЗИ) органов малого таза трансвагинальным доступом, обладающее большой чувствительностью и специфичностью [3]. В дополнение к УЗ-методу применяются: 3D-УЗИ, магнитно-резонансная томография (МРТ), гистероскопия с раздельным диагностическим выскабливанием (РДВ), гистерорезектоскопия, позволяющая одномоментно удалить субмукозные узлы, размеры которых не превышают 4–5 см [4–6]. Пациенткам с бесплодием может быть дополнительно проведена гидросонография, преимуществами которой является возможность избежать более инвазивных исследований и точно определить тип миомы и степень деформации полости матки [6]. С целью дифференциальной диагностики доброкачественных и злокачественных образований используется МРТ [7, 8].
Среди возможных доступных вариантов лечения миомы матки выделяют: консервативное лечение, рентгенэндоваскулярный метод эмболизации маточных артерий (ЭМА), ФУЗ-аблацию миомы матки, но основным методом является хирургический. Согласно клиническим рекомендациям «Миома матки» Минздрава России 2020 г.1 консервативное лечение миомы матки включает комплексное применение гемостатической, противовоспалительной терапии (нестероидные противовоспалительные препараты (НПВП)) в комбинации с гормональной терапией. Для уменьшения объема кровопотери и снижения уровня болевого синдрома целесообразно использовать транексамовую кислоту [9] и НПВП1. Пероральные прогестагены уменьшают симптомы заболевания, но не оказывают влияния на стабилизацию или уменьшение роста миоматозных узлов. Однако они могут быть использованы для уменьшения объема аномального маточного кровотечения (АМК) и для профилактики гиперпластических процессов эндометрия, сопряженных с миомой матки [10, 11]. У таких пациенток также будет оправдано использование внутриматочной терапевтической системы с левоноргестрелом, но она также не влияет на размер узлов [11, 12]. Кроме того, могут быть назначены комбинированные оральные контрацептивы, однако они снижают объем менструальной кровопотери [13–15], но также не влияют на рост миоматозных узлов [16]. В качестве пред-операционного лечения, а также для уменьшения размеров миоматозных узлов и уменьшения интраоперационной кровопотери используют агонисты гонадотропин-рилизинг-гормона (аГнРГ) [14, 16]. Большинству пациенток с миомой матки необходимо хирургическое вмешательство, так как на данный момент оно является единственным эффективным методом лечения.
Могут быть проведены следующие хирургические вмешательства: органосохраняющая лапароскопическая или лапаротомическая миомэктомия, эндоваскулярная ЭМА и гистерэктомия. Пациенткам, планирующим беременность, выполняют органосохраняющую операцию (миомэктомию) [15, 17, 18]. При отсутствии репродуктивных планов и наличии показаний выполняют гистерэктомию [3, 13, 16], при размерах матки до 12 нед. – влагалищную гистерэктомию [19]. Пациенткам с высоким операционным риском, не планирующим беременность, выполняют эндоваскулярную ЭМА [4, 8, 16, 20]. При наличии противопоказаний к оперативному лечению выполняют ФУЗ-аблацию [16].
Лапароскопический метод минимизирует риск развития осложнений. Наиболее частыми осложнениями являются: избыточная кровопотеря, гематома миометрия и развитие морцеллом [5]. Согласно классификации Clavien-Dindo [21] к осложнениям также относятся: ранение мочевого пузыря, незапланированная экстирпация матки, разрыв матки в родах и при беременности, образование ниши, ранение кишечника, спаечная кишечная непроходимость, перитонит, несостоятельность швов, тромбоэмболия легочной артерии, раневая инфекция, послеоперационные грыжи, болевой синдром, нагноение швов и др. Спаечный процесс в полости матки или в брюшной полости может влиять на фертильность, а дефекты миометрия сопряжены с риском разрыва матки во время последующих беременностей [22].
Цель исследования: оценка безопасности и эффективности миомэктомии и развития интраоперационных и послеоперационных осложнений.
Материал и методы
На базе ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ» c января 2019 г. по декабрь 2022 г. было выполнено 268 миомэктомий. Была разработана база данных для сбора информации о наблюдаемых пациентках. Данные были собраны и проанализированы ретроспективно: проводилась ретроспективная оценка историй болезни, анкетирование по телефону и с помощью писем. Из 268 пациенток данные были получены от 219 (81,72%), не ответили на вопросы анкеты 32, в 17 случаях контактные данные были указаны неверно.
Диагноз устанавливали с помощью УЗИ органов малого таза трансвагинальным или абдоминальным доступом. Показаниями к операции были бесплодие, тянущие боли в нижней части живота, ассоциированные с возможным нарушением питания узлов или нарушением функции соседних органов, значительное увеличение матки, АМК, нарушение мочеиспускания и констипация, миома матки размерами ≥4 см.
Все операции были выполнены шестью ведущими гинекологами-хирургами гинекологического отделения, которые использовали различные хирургические техники.
Всем пациенткам до операции, помимо стандартной предоперационной подготовки, по показаниям проводили 3D-УЗИ, МРТ, допплерографию. Также выполняли пайпель-биопсию эндометрия, гистероскопию и РДВ. Пациентки, которым проводили трансцервикальную гистерорезектоскопию, не были включены в исследование. Пациенткам с миомами больших размеров в качестве пред-операционной подготовки назначали препараты аГнРГ.
Время операции отсчитывалось от первого разреза и до наложения последнего шва, время анестезии — с момента установки положения пациентки и индукции анестезии до пробуждения, время ишемии матки — от наложения последней клипсы до снятия первой. Лапароконверсия осуществлялась при осложнениях и технических трудностях во время операции. Кровопотерю измеряли гравиметрическим методом совместно с анестезиологами. Оценивали наличие интра- и послеоперационных осложнений. Послеоперационный уровень гемоглобина, наблюдаемый в течение недели, сравнивали с предоперационным, и таким образом рассчитывали изменение уровня гемоглобина в периоперационном периоде. Послеоперационной лихорадкой считали температуру тела 38 °C при двух последовательных измерениях с интервалом не менее 6 ч, исключая первые 24 ч. Инфекцию мочевыводящих путей регистрировали при количестве микроорганизмов более 105 колониеобразующих единиц/мл мочи, при отборе через 1 день после удаления мочевого катетера или после возникновения симптомов. Рассчитывали количество койко-дней. Для проверки адекватности заживления рубца после миомэктомии проводили трансвагинальное УЗИ через 6 мес. Информация о последующей фертильности и акушерских результатах была получена от пациенток при повторном осмотре и анкетировании. В исследование включались только пациентки со сроком наблюдения ≥10 мес.
Оперативная техника
Хирурги использовали лапароскопическую и лапаротомическую техники миомэктомий. Для предотвращения избыточной кровопотери при лапароскопической миомэктомии хирурги использовали несколько техник:
Наложение клипс или эндоскопических зажимов по типу Buldog в месте отхождения маточных артерий от внутренней подвздошной артерии, латеральнее мочеточника и на воронко-тазовые связки с двух сторон. Доступ к маточной артерии осуществлялся через пространство Лацко. После чего ультразвуковым скальпелем, монополярным или биполярным электродом, проводили разрез миометрия над узлом.
Гидропрепаровку с использованием раствора адреналина (1000 мл физиологического раствора NaCl и 1 мл 1% адреналина) или вазопрессина. В зависимости от размера и локализации миоматозных узлов вводили 20–100 мл раствора в миометрий с помощью пункционной иглы, введенной в один из троакаров.
Использование продвинутой биполярной коагуляции по типу LigaSure или применение ультразвуковой энергии, обладающей гемостатическим эффектом, при этом вызывали минимальное термическое повреждение прилежащих тканей.
Далее проводили вылущивание узла без вскрытия или со вскрытием полости матки. Ложе узлов ушивали в зависимости от размера дефекта и от предпочтений хирурга отдельными однорядными узловыми, отдельными двухрядными узловыми или непрерывными двухрядными швами. В качестве шовного материала использовали нити на основе полигидроксиацетиловой (ПГА) кислоты. Узлы удаляли из брюшной полости при помощи морцеллятора через разрез в левой подвздошной области (10 или 15 мм) или при помощи мини-лапаротомии по Пфанненштилю. В брюшную полость вводили пассивный дренаж через правую подвздошную область по показаниям. Для профилактики послеоперационных грыж дефект фасции восстанавливали швами с использованием ПГА-нитей. Ряду пациенток в брюшную полость вводили противоспаечные барьеры на основе окисленной регенерированной целлюлозы для снижения операционных осложнений.
Лапаротомическая миомэктомия являлась методом выбора при атипичном или интрамуральном расположении множественных миом больших размеров. Был использован доступ по Пфанненштилю или нижнесрединная лапаротомия. Проводили разрез над миоматозным узлом, далее выполняли вылущивание узла тупым и острым путем с/без вскрытия полости матки. Целостность матки восстанавливали узловыми швами с использованием ПГА-нитей.
Статистическая обработка результатов
В зависимости от распределения данные представлены в виде медианы и квартилей (Me [Q1; Q3]) или среднего и стандартного отклонения. Статистические расчеты проводили в программе STATISTICA 14 с применением описательной статистики и непараметрических методов в случаях, когда выборки не подчинялись нормальному распределению. Для изучения взаимосвязи объема кровопотери с размером и количеством удаленных миоматозных узлов использовались непараметрические методы корреляционного анализа.
Результаты исследования
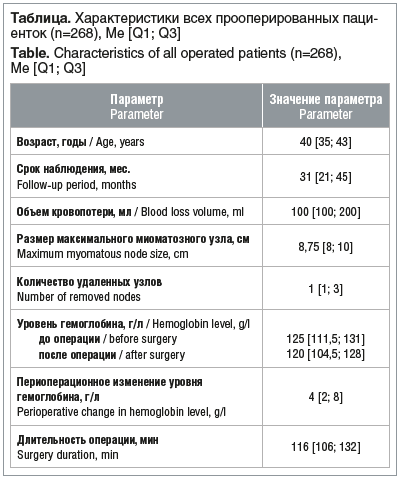
Было выполнено 268 миомэктомий, из которых одиночных — 153 (57,00%) и множественных — 115 (43,00%). Информация была собрана и проанализирована от большей части пациенток (219 (81,72%)). В таблице представлены характеристики 268 пациенток.
В проведенном исследовании у 133/219 (60,73%) пациенток миомы проявлялись такими клиническими симптомами, как: АМК в 92/133 (69,17%) случаях, тянущие боли в 70/133 (52,63%) случаях, нарушение функции смежных органов (затруднение мочеиспускания и акта дефекации) в 33/133 (24,81%) случаях. У многих пациенток наблюдалось сочетание вышеописанных жалоб: боли и АМК отмечались в 26/133 (19,55%) случаях, боли и нарушение функции смежных органов — в 6/133 (4,51%), АМК и нарушение функции смежных органов — в 13/133 (9,77%) и сочетание всех трех жалоб — в 9/133 (6,77%).
По показаниям были проведены: 3D-УЗИ — 67/268 (25%) пациенткам, МРТ — 59/268 (22,01%), гистероскопия с РДВ — 239/268 (89,18%), гистерорезектоскопия — 30/268 (11,19%) пациенткам. Патология труб была выявлена у 26/268 (9,70%) женщин (гидросальпингс), патология яичников — у 42/268 (15,67%) (доброкачественные опухоли яичников: эндометриоидные — у 21/268 (7,84%), цистаденомы — у 16/268 (5,97%), тератомы — у 5/268 (1,87%)). Этим пациенткам были проведены операции на придатках.
Перед миомэктомией проводилась медикаментозная терапия аГнРГ в 52/268 (19,40%) и ЭМА в 2/268 (0,75%) случаях. У 155/268 (57,84%) женщин было обнаружено >1 миомы, максимальное количество удаленных узлов составило 15 (среднее количество удаленных узлов 2,15).
Размер миомы варьировал от 4 до 25 см. Деформация полости матки наблюдалась у 56/268 (20,89%) пациенток, вскрытие полости матки было у 52/268 (19,4%). В исследовании преобладали пациентки с большими миоматозными узлами: средний диаметр узлов составлял 9,02 см. Во время миомэктомии по поводу крупных миом также проводилось удаление миом размером <4 см с целью профилактики рецидивирования.
Лапаротомия по Пфанненштилю выполнена 8/15 (53%) пациенткам, нижнесрединная лапаротомия — 7/15 (47%) пациенткам. Релапароскопий и релапаротомий не проводилось. Лапароконверсия была выполнена в 6/268 (2,24%) случаях.
При выполнении миомэктомии временное клипирование маточных сосудов проводилось 40/268 (14,92%) пациенткам, продвинутая биполярная коагуляция и ультразвуковая энергия — 187/268 (69,78%), инъекция физиологического раствора, адреналина или вазопрессина — 107/268 (39,93%). Сочетание временного клипирования маточных артерий и продвинутой биполярной коагуляции и ультразвуковой энергии применяли у 52/268 (19,40%) пациенток, а 31/268 (11,56%) пациентке проводилось сочетание инъекции физиологического раствора, адреналина или вазопрессина и продвинутой биполярной коагуляции и ультразвуковой энергии. Восстановление целостности матки после вылущивания миоматозного узла, в зависимости от глубины ложа, проводилось различными техниками наложения швов: отдельные однорядные узловые — в 108/268 (40,30%) случаях, отдельные двухрядные узловые или непрерывные двухрядные — в 93/268 (34,70%) и в 67/268 (25,00%) случаях соответственно. Противоспаечные барьеры вводили 10/268 (3,73%) пациенткам.
Среднее время ишемии матки составило 66,5 [64,5; 85,5] мин и не превышало 90 мин. После операции трансфузионная терапия потребовалась в 2/268 (0,75%) случаях в связи с анемией тяжелой степени. Также 18/268 (6,72%) пациенткам, у которых в послеоперационном периоде была выявлена анемия средней степени тяжести, внутривенно вводили препараты железа, при выписке назначались препараты железа в таблетированной форме и сдача клинического анализа крови в динамике с определением уровня железа через 1 мес. после выписки. На рисунках 1 и 2 показана корреляция объема кровопотери с количеством удаленных узлов (p=0,072) и диаметром максимального узла (p<0,01).
![Таблица. Характеристики всех прооперированных паци- енток (n=268), Ме [Q1; Q3] Table. Characteristics of all operated patients (n=268), Me [Q1; Q3] Таблица. Характеристики всех прооперированных паци- енток (n=268), Ме [Q1; Q3] Table. Characteristics of all operated patients (n=268), Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/bd6/datwy81eyl9p31z7u2hsmdde38kh1yjw/20-1.png)


После лапаротомической миомэктомии проводилось обезболивание наркотическими анальгетиками всем 15 пациенткам, после лапароскопической миомэктомии — НПВП в 160/253 (63,24%) случаях и наркотическими анальгетиками в 108/253 (42,69%) случаях.
Таких интраоперационных осложнений, как ранение мочевого пузыря, кишечника или незапланированная экстирпация матки, не зарегистрировали.
Структура послеоперационных осложнений представлена на рисунке 3. В раннем послеоперационном периоде у 18/268 (6,72%) пациенток отмечалась лихорадка (двукратный подъем температуры до 38 °С), которая успешно купировалась парацетамолом. У 13/268 (4,85%) пациенток выявлена инфекция нижних мочевыводящих путей, которая была успешно пролечена фосфомицином. У 1/268 (0,37%) пациентки было отмечено нагноение шва, которое успешно устранили консервативно. Динамическая кишечная непроходимость, которая самопроизвольно разрешилась, развилась у 10/268 (3,73%) пациенток. В позднем послеоперационном периоде у 1/268 (0,37%) пациентки в левой подвздошной области возникла послеоперационная грыжа, несмотря на ушивание апоневроза.

После операции в 4/268 (1,49%) случаях была проведена установка внутриматочной гормональной системы с левоноргестрелом. Среднее число койко-дней составило 2–7.
Впоследствии у 32/219 (14,61%) женщин был отмечен рецидив миомы, у 1/219 (0,46%) из них было проведено повторное оперативное вмешательство в объеме гистерэктомии. У 4/219 (1,83%) пациенток после операции возникло АМК вследствие развития аденомиоза. Повторное оперативное лечение экстрагенитальной патологии и операция кесарево сечение проведены 18/219 (8,21%) пациенткам. У 2/219 (0,91%) перитонеальные спайки были обнаружены во время операции кесарева сечения, у остальных 11/219 (5,02%) во время лапароскопических операций (при холецистэктомии — у 2/219 (0,91%), при аппендэктомии — у 4/219 (1,83%) и при диагностической лапароскопии у 5/219 (2,28%)). У 5/219 (2,28%) пациенток спаечный процесс интраоперационно не обнаружен.
Планировали беременность до операции 53/219 (24,20%) пациентки, из которых у 5/53 (9,43%) поменялись планы, 28/53 (52,83%) смогли забеременеть, еще 4/53 (7,54%) были беременны на момент анкетирования, 9/53 (16,98%) пациенток на момент проведения анкетирования пытались забеременеть, не смогли забеременеть 7/53 (13,20%) женщин.
У 4/219 (1,83%) пациенток наблюдалось снижение овариального резерва. Естественное зачатие наступило у 30/219 (13,69%) пациенток. К методу вспомогательных репродуктивных технологий прибегли 2/219 (0,91%) пациентки. Рецидив миомы случился у 3/219 (1,36%) женщин. После операции смогли забеременеть 7/219 (3,20%) пациенток, которые не планировали этого изначально. Всего 39/219 (17,8%) пациенток смогли забеременеть. Осуществить репродуктивную функцию, т. е. забеременеть и родить, на момент анкетирования смогли 35/219 (15,98%) пациенток.
Родоразрешены путем операции кесарева сечения 12 женщин: 4 из них в связи со слабостью родовой деятельности, 5 — в связи с рубцом по задней стенке матки и 3 — в связи с возрастом старше 40 лет. При интраоперационной оценке матки все рубцы были без ниш и деформаций и признаны акушерами удовлетворительными. У 19 пациенток родоразрешение выполнено через естественные родовые пути. Все 36 рожденных детей были здоровы, средняя масса тела их составила 3200±600 г, по шкале Апгар средний результат составил 8±1,5.
Состояние рубца после операции оценивалось при помощи УЗИ органов малого таза: состоятельный рубец наблюдался у 203/219 (92,69%), у остальных 16/219 (7,31%) инструментального обследования не проводилось.
Обсуждение
Дискуссии о целесообразности и безопасности лапароскопической миомэктомии у молодых женщин, планирующих реализовать репродуктивную функцию, не утихают. На основании проведенного анализа данных можно с уверенностью сказать, что при соблюдении общехирургических принципов — минимальное термическое воздействие на матку, адекватное, послойное восстановление целостности стенки матки без формирования «мертвых пространств», применение инертного шовного материала и профилактических мероприятий для снижения интраоперационной кровопотери — лапароскопическая миомэктомия может быть выполнена у молодых пациенток даже при больших, 12–15 см, узлах при условии хорошего оснащения операционной и слаженности операционной бригады. Немаловажным является безупречное владение всеми видами наложения эндошвов. Наши данные подтверждаются результатами многоцентровых исследований с большими выборками [23].
Заключение
Проведенное нами ретроспективное исследование результатов 268 миомэктомий и осложнений, возникающих периоперационно, позволяет предположить, что лапароскопическая миомэктомия является методом выбора при миоме матки, так как повышает качество жизни пациенток и позволяет реализовать репродуктивную функцию без осложнений.
1Министерство здравоохранения Российской Федерации. Миома матки. Клинические рекомендации. (Электронный ресурс.) URL: https://mosgorzdrav.ru/ru-RU/science/default/download/808.html (дата обращения: 20.02.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Слободянюк Борис Александрович — к.м.н., доцент кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач акушер-гинеколог гинекологического отделения ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0009-0005-9578-1755
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290
Димитрова Валентина Ивановна — к.м.н., врач акушер-гинеколог гинекологического отделения ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1.
Маркова Элеонора Александровна — к.м.н., доцент кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; врач акушер-гинеколог гинекологического отделения ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0000-0002-9491-9303
Слюсарева Ольга Александровна — к.м.н., врач акушер-гинеколог гинекологического отделения ГБУЗ «ГКБ им. Ф.И. Иноземцева ДЗМ»; 105187, Россия, г. Москва, ул. Фортунатовская, д. 1; ORCID iD 0000-0001-9279-7851
Аббасова Лейла Яшар кызы — клинический ординатор 1-го года кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0006-1701-8620
Путря Анна Викторовна — клинический ординатор 1-го года кафедры акушерства и гинекологии института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0003-6628-3357
Мударисова Арина Равилевна — клинический ординатор 1-го года кафедры онкологии, гематологии и лучевой терапии института материнства и детства ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0001-9868-7239
Ушакова Вероника Александровна — студентка 4-го курса лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0000-0424-0165
Федяев Денис Александрович — клинический ординатор 1-го года по специальности «сердечно-сосудистая хирургия» ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»; 129090, Россия, г. Москва, Большая Сухаревская пл., д. 3; ORCID iD 0009-0009-7172-3496
Зарипова Альмира Айдаровна — студентка 5-го курса лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0007-3160-778
Яратова Алина Ильшатовна — студентка 4-го курса лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0009-0006-9223-0314
Контактная информация: Слободянюк Борис Александрович, e-mail: borisslo@inbox.ru
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.07.2024.
Поступила после рецензирования 25.07.2024.
Принята в печать 19.08.2024.
ABOUT THE AUTHORS:
Boris A. Slobodyanyuk — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; obstetrician-gynecologist of the Department of Gynecology, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0009-0005-9578-1755
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Faculty of General Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD: 0000-0002-7830-2290
Valentina I. Dimitrova — C. Sc. (Med.), obstetrician-gynecologist of the Department of Gynecology, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation.
Eleonora A. Markova — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical
University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; obstetrician-gynecologist of the Department of Gynecology, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-9491-9303
Olga A. Slyusareva — C. Sc. (Med.), obstetrician-gynecologist of the Department of Gynecology, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0001-9279-7851
Leila Yashar kyzy Abbasova — 1st-year clinical resident at the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0006-1701-8620
Anna V. Putrya — 1st-year clinical resident at the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0003-6628-3357
Arina R. Mudarisova — 1st-year clinical resident at the Department of Oncology, Hematology and Radiation Therapy of the Institute of Motherhood and Childhood, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0001-9868-7239
Veronika A. Ushakova — 4th-year student of the Faculty of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0000-0424-0165
Denis A. Fedyaev — 1st-year clinical resident specializing in Cardiovascular Surgery, N.V. Sklifosovsky Research Institute for Emergency Medical Aid; 3, Bolshaya Sukharevskaya Square, Moscow, 129090, Russian Federation; ORCID iD 0009-0009-7172-3496
Almira A. Zaripova — 5th-year student of the Faculty of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0007-3160-778
Alina I. Yaratova — 4th-year student of the Faculty of Medicine, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0009-0006-9223-0314
Contact information: Boris A. Slobodyanyuk, e-mail: borisslo@inbox.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.07.2024.
Revised 25.07.2024.
Accepted 19.08.2024.