Введение
В фокусе современных исследований в области физиологии и медицины все чаще оказываются изменения композиционного состава тела (КСТ), которые играют ключевую роль в поддержании здоровья и развитии некоторых заболеваний [1]. Состав тела, включающий пропорции жировой, мышечной и костной тканей, подвержен динамическим изменениям под влиянием множества факторов [2]. Среди них особое значение имеют биологические механизмы, регулируемые интерлейкинами и адипокинами [3, 4]. Понимание их взаимодействия открывает новые возможности для разработки стратегий профилактики и лечения заболеваний, связанных с изменением КСТ [5, 6].
Цель настоящего обзора — представить современные данные о роли интерлейкинов и адипокинов в формировании изменений КСТ, что может послужить основой для дальнейших исследований и практического применения в клинической медицине.
Проведен анализ научной литературы, посвященной роли адипокинов и цитокинов в развитии ожирения, саркопении и остеопении. Использованы публикации (оригинальные исследования, обзоры и метаанализы) из баз данных PubMed, Scopus и Web of Science за 2002–2025 гг. Всего по поисковым словам была обнаружена 131 публикация, из которых в итоговый обзор вошли 85 источников. Для поиска литературы были использованы следующие ключевые слова: «адипокины», «интерлейкины», «композиционный состав тела», «ожирение», «саркопения» и «остео-пения». Включены экспериментальные работы на животных и клеточных моделях, раскрывающие молекулярные пути регуляции воспаления, инсулинорезистентности и ремоделирования костной ткани.
Роль цитокинов и адипокинов в развитии ожирения
Ожирение, традиционно определяемое как избыточное накопление жировой ткани, негативно влияющее на здоровье, в клинической практике обычно оценивается с помощью индекса массы тела [7]. В России распространенность ожирения среди взрослых неуклонно растет. По данным популяционного исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации) 2012–2024 гг., стандартизованная по возрасту распространенность ожирения составила 26,9% среди мужчин и 30,8% среди женщин [8]. По прогнозам, к 2050 г. распространенность избыточной массы тела и ожирения среди взрослых в США достигнет 81,1% у мужчин и 82,1% у женщин, при этом ожирение будет встречаться у 55,3% мужчин и 58,8% женщин [9]. С возрастом жировая ткань подвергается ремоделированию (увеличение висцерального жира, фиброз, клеточное старение адипоцитов), что запускает хроническое воспаление (low-grade inflamation). Данный процесс ведет к активации иммунных клеток (макрофаги фенотипа M1, Т-клетки) с выделением провоспалительных интерлейкинов (interleukin (IL) 1β, IL-6, фактор некроза опухоли (tumor necrosis factor (TNF) α) и к дисфункции адипоцитов с нарушением секреции адипокинов [10]. Интерлейкины и адипокины высвобождаются в ответ на старение клеток и метаболический стресс, что в совокупности потенцирует хроническое системное воспаление [11, 12]. В дальнейшем воспалительные цитокины играют двойственную роль в регуляции метаболических процессов, способствуя как развитию, так и подавлению ожирения. Провоспалительные цитокины, такие как TNF-α, IL-1β, IL-6, интерферон (interferon, IFN) γ и IL-18, уровень которых повышается при изменении баланса между макрофагами фенотипов M1 и M2 в стареющей жировой ткани, являются ключевыми медиаторами хронического воспаления, характерного для ожирения [13, 14]. Например, повышение уровня TNF-α способствует развитию инсулинорезистентности, нарушению остеогенеза и катаболизму мышечной ткани, хотя также сообщается о его потенциальном липолитическом действии [15, 16]. Повышенный уровень IL-6, с одной стороны, способствует висцеральному ожирению и понижает чувствительность тканей к инсулину, а с другой — в нейронах гипоталамуса подавляет активность центра голода, снижая тем самым потребление пищи [16–18]. Высвобождение IL-1β индуцирует апоптоз β-клеток поджелудочной железы, усугубляя нарушения углеводного обмена [19]. IL-18 классически рассматривается как провоспалительный цитокин за счет индукции IFN-γ и активации ядерного транскрипционного фактора каппа B (nuclear transcription factor kappa B — ТNF-κB), что было описано на мышиных моделях. Так, мыши с нокаутом гена IL-18 проявляли гиперфагию и набирали массу значительно быстрее в сравнении с контрольной группой, в том числе за счет инсулинорезистентности, а центральное и периферическое введение экзогенного IL-18 сопровождалось снижением аппетита и восстановления массы тела у мышей с недостатком питания [20]. Напротив, противовоспалительные цитокины, такие как IL-4, IL-10, IL-22 и IL-33, играют важную роль в поддержании энергетического баланса и преимущественно препятствуют развитию ожирения [21]. IL-10 подавляет действие провоспалительных цитокинов (IL-6, IL-33, моноцитарный хемоаттрактантный белок 1 (CCL2), TNF-α и IL-1β), повышает чувствительность тканей к инсулину и может стимулировать активность бурой жировой ткани, хотя при этом способен индуцировать продукцию IFN-γ, вероятно, за счет активации CD8+ T-клеток и снижать уровень гемоглобина и тромбоцитов, нарушая метаболизм железа, что может негативно влиять на изменения КСТ [22, 23]. IL-4 и IL-13 способствуют активации M2-макрофагов, которые подавляют хроническое воспаление и поддерживают метаболический баланс за счет подавления печеночного глюконеогенеза и снижения концентрации глюкозы в сыворотке крови, однако в некоторых случаях IL-4 может стимулировать дифференцировку преадипоцитов в зрелые адипоциты, а наряду с секрецией IL-13 — вызывать фиброз белой жировой ткани, что способствует увеличению жировой массы [24–26]. Кроме того, повышенный уровень IL-22 сопровождается повышением проницаемости кишечника и стимулирует липолиз, однако провоспалительные эффекты данного интерлейкина обусловливают накопление жировой ткани [27, 28].
Адипокины, представляющие собой биологически активные молекулы, секретируемые жировой тканью, играют центральную роль в регуляции метаболического гомеостаза и являются одним из звеньев патогенеза ожирения [29]. Среди них особую роль играет адипонектин, обладающий противовоспалительными и инсулинсенсибилизирующими свойствами. Повышенный уровень адипокина сопровождается усилением липолиза, снижением уровня провоспалительных цитокинов и стимуляцией антифиброзной активности в различных органах и тканях [30–32]. Омега-3-зависимые адипокины, такие как мареспины и резолвины, обладая противовоспалительными свойствами, снижают нейтрофильную инфильтрацию жировой ткани и стимулируют фагоцитоз апоптотических клеток макрофагами, тем самым улучшая липидный обмен [33]. Среди адипокинов с липогенетическим действием выделяют резистин и висфатин, повышенный уровень которых способствует развитию инсулинорезистентности, хронического воспаления и накоплению жировой ткани [34, 35]. Лептин является одним из важнейших адипокинов, регулирующих энергетический обмен. При секреции лептина в центральной нервной системе подавляется чувство голода, а в тканях данный адипокин стимулирует липолиз. Однако при ожирении в результате лептинорезистентности развивается гиперфагия, которая приводит к увеличению массы тела за счет накопления жировой ткани [36, 37]. Химерин играет двойственную роль в регуляции метаболизма. В норме он участвует в дифференцировке адипоцитов и может повышать чувствительность к инсулину, однако при ожирении его повышенный уровень способствует секреции провоспалительных цитокинов, таких как IL-6 и TNF-α, тем самым усугубляя хроническое воспаление и инсулинорезистентность [38, 39]. Напротив, биоактивный пептид несфатин-1, взаимодействующий с ядрами гипоталамуса и нейронными цепями, контролирует пищевое поведение и в физиологических концентрациях оказывает благоприятное влияние на метаболизм, подавляя аппетит, стимулируя липолиз, снижая окислительный стресс и улучшая чувствительность к инсулину. Он также обладает антиапоптотическими и противовоспалительными свойствами и способен активировать метаболические реакции в бурой жировой ткани, повышая термогенез и расход калорий [40–42]. Однако при патологических состояниях сывороточный уровень несфатина-1 может снижаться, что связано с развитием ожирения и нарушением метаболических процессов. Таким образом, адипокины крайне важны в сложном и многогранном патогенезе ожирения. Их дисбаланс может предшествовать видимому увеличению жировой массы и способствовать его развитию за счет формирования порочного круга «адипокины ® инсулинорезистентность ® усиленное отложение жира ® еще большее нарушение секреции адипокинов».
Цитокины и адипокины в патогенезе саркопении
Саркопения характеризуется уменьшением мышечной массы, силы и функциональных возможностей [43]. Согласно данным исследований, распространенность саркопении среди лиц пожилого возраста варьирует от 17 до 60%, достигая 50% у пациентов старше 80 лет. Патогенез саркопении связан с комплексом взаимосвязанных процессов, включающих снижение анаболических реакций, активацию протеолиза, хроническое системное воспаление, развитие инсулинорезистентности, нарушение митохондриальной функции, ухудшение нейромышечной передачи и гиподинамию [44–46]. При этом полагают, что профилактическими в отношении саркопении эффектами могут обладать адипонектин и противовоспалительные цитокины (IL-10, IL-4, IL-13), которые модулируют воспалительные реакции и оказывают анаболическое действие на мышечную ткань, снижая воспаление и поддерживая баланс М2-макрофагов, которые предотвращают разрушение мышц [47–50]. IL-13, продукция которого индуцируется во время мышечного сокращения путем активации рецептора IL-13Rα1, запускает метаболическое перепрограммирование, которое переключает энергообмен с использования гликогена на окисление жирных кислот, повышая выносливость и улучшая толерантность к глюкозе, что в совокупности оптимизирует энергосбережение мышц и их адаптацию к физическим нагрузкам [51]. Фактор роста фибробластов 21 (Fibroblast growth factor 21, FGF21) регулирует энергетический обмен и связан с повышенной выработкой бурого жира, что может предотвращать саркопению, однако более высокий уровень циркулирующего FGF21 был связан с вероятностью развития саркопении и ухудшением силы хвата у пожилых людей [52]. Провоспалительные цитокины, включая TNF-α, TNF-β, IL-6, IL-1β и IL-18, играют ключевую роль в индукции катаболических реакций в мышцах. Они активируют сигнальный путь NF-κB, потенцируют апоптоз миоцитов и способствуют деградации мышечных белков [53, 54]. Эти же цитокины связаны с инсулинорезистентностью и накоплением висцерального жира, что усугубляет саркопению. Физическая активность, включая силовые и аэробные упражнения, оказывает положительное влияние на мышечную ткань, активируя сигнальный путь мишени рапамицина у млекопитающих (mammalian target of rapamycin — mTOR), который стимулирует синтез миофибриллярных белков и снижает уровень провоспалительных цитокинов, таких как TNF-α, тем самым препятствуя развитию саркопении [55, 56]. Лептин оказывает комплексное влияние на скелетные мышцы, действуя как напрямую — через аутокринные и паракринные механизмы, так и опосредованно — через подавление центра голода в головном мозге [37]. Мышечная ткань сама способна вырабатывать лептин, который приводит к усилению окисления жирных кислот, подавлению накопления липидов и повышению чувствительности к инсулину. Также лептин, связываясь с рецептором b к лептину (Leptin receptor b — LepRb) в гипоталамусе, приводит к высвобождению проопиомеланокортина (Pro-opiomelanocortin — POMC), активируя тем самым симпатическую нервную систему, что повышает доступность жирных кислот для мышц, а также увеличивает расход калорий через термогенез. При физических нагрузках эти механизмы способствуют переходу на жировой метаболизм и повышению выносливости, тогда как при ожирении развивается лептинорезистентность, нарушающая окислительные процессы в мышцах и способствующая накоплению в них липидов (миостеатоз), что ухудшает их функцию. Кроме того, при снижении уровня лептина, например при голодании, замедляется мышечный метаболизм, что может провоцировать катаболические реакции в мышечной ткани. Таким образом, лептин играет ключевую роль в регуляции энергетического метаболизма мышц, но его эффективность зависит от общего метаболического статуса организма [57–59]. Химерин играет важную роль в регуляции работы мышц. При диабете и ожирении его высокий уровень ухудшает энергетический обмен в мышцах, снижая количество митохондрий и активность метаболических процессов в них. Однако физические нагрузки помогают снизить уровень химерина и улучшить мышечный метаболизм. Уменьшение содержания химерина способствует росту и развитию мышечных клеток, но полное блокирование его рецептора CMKLR1 дает неоднозначный эффект: кратковременное увеличение силы, но долгосрочное снижение выносливости из-за уменьшения количества стволовых клеток мышц и нарушений в работе кальциевой системы [60–62]. Эти данные подчеркивают двойственную роль химерина в мышцах: с одной стороны, его избыток при метаболических нарушениях ухудшает энергетический обмен, с другой — физиологический уровень необходим для поддержания мышечной адаптации к нагрузкам и контроля жирового гомеостаза. Терапевтическая модуляция химериновой сигнализации может быть перспективной для коррекции метаболических миопатий и возрастной саркопении. Резолвин D3 (resolving — RD3) представляет собой эндогенный липидный медиатор, синтезируемый из омега-3 полиненасыщенных жирных кислот, в частности из докозагексаеновой кислоты. Молекулярные механизмы действия RD3 включают ингибирование зависимой от NF-κB транскрипции провоспалительных цитокинов (TNF-α, IL-1β, IL-6), подавление хемотаксиса нейтрофилов и усиление фагоцитарной активности макрофагов. В контексте метаболических нарушений RD3 демонстрирует уникальную способность модулировать инсулиновую сигнализацию через активацию AMФ-зависимой протеинкиназы, что приводит к усилению транслокации GLUT4 в скелетных мышцах и улучшению утилизации глюкозы. Одновременно RD3 ингибирует липогенез в гепатоцитах посредством подавления экспрессии стерол-регулирующего элемент-связывающего белка 1 (sterol regulatory element-binding protein 1 — SREBP1) и стеароил-КоА-десатуразы 1 (stearoyl-coenzyme A desaturase 1 — SCD1), что подтверждается снижением накопления триглицеридов в экспериментальных моделях неалкогольной жировой болезни печени. Терапевтический потенциал RD3 в лечении метаболических нарушений подчеркивается его способностью одновременно воздействовать на несколько ключевых патогенетических звеньев: инсулинорезистентность, хроническое воспаление низкой степени и дислипидемию, что делает его перспективным кандидатом для разработки новых стратегий лечения изменений КСТ [63].
Развитие остеопении на фоне взаимодействия цитокинов и адипокинов
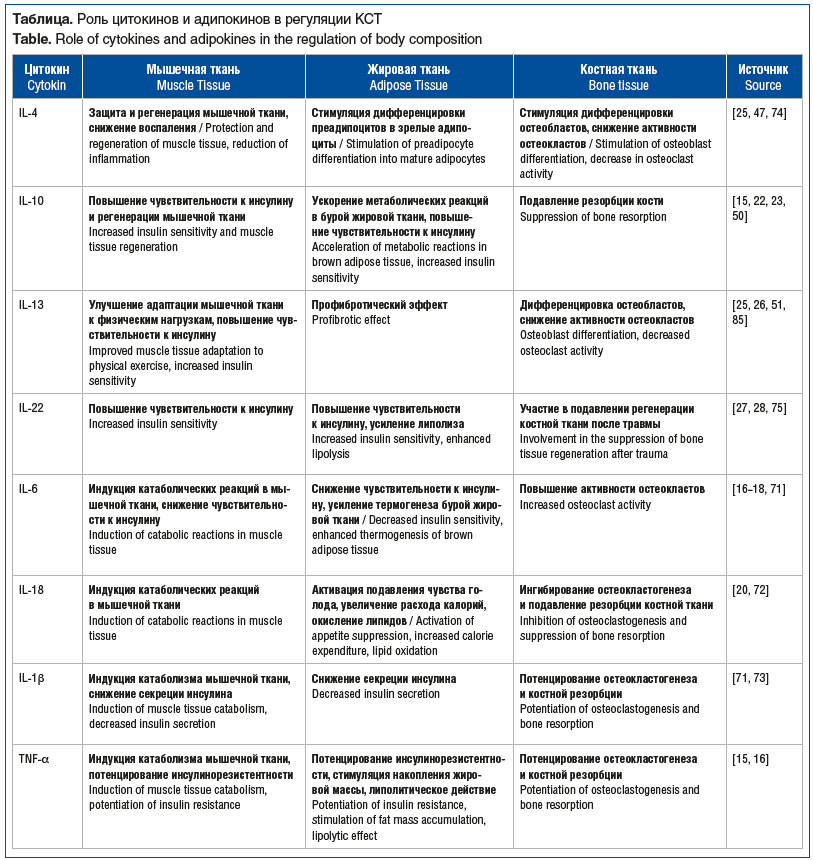
Остеопения — состояние, при котором наблюдается снижение минеральной плотности кости (МПК), не достигающее при этом степени остеопороза. Распространенность остеопении составляет 27–54% среди женщин в постменопаузе, хотя показатели разнятся в зависимости от возрастных и географических данных [64]. В России распространенность остеопороза у лиц старше 50 лет составляет 34% среди женщин и 27% среди мужчин, а частота остео-пении — 43 и 44% соответственно [65]. Развитие остео-пении определяется сложными взаимодействиями воспалительных цитокинов, гормонов, адипокинов, генетических и эпигенетических факторов. Эти механизмы тесно связаны с патогенезом саркопении и ожирения, формируя взаимо-связанный каскад метаболических и структурных нарушений в организме [66–68]. Провоспалительные цитокины, такие как TNF-α, IL-6, IL-1β и IL-18, играют ключевую роль в патогенезе остеопении, способствуя разрушению костной ткани через активацию остеокластогенеза [69]. В частности, TNF-α и TNF-β ингибируют дифференцировку остеобластов и усиливают резорбцию кости, что приводит к снижению костной массы [70, 71]. IL-6, в свою очередь, повышает активность остеокластов и ассоциирован с развитием постменопаузального остеопороза [71]. IL-18 обладает сложным регуляторным действием на метаболические процессы в костной ткани. С одной стороны, он ингибирует остеокластогенез, вызывая апоптоз миелоидных клеток через Fas-сигнализацию и синергично с ФНО-α усиливая высвобождение NO остеобластами и остеокластами. Кроме того, IL-18 опосредованно подавляет резорбцию кости за счет стимуляции секреции IFN-γ в Т-клетках. Однако при нарушении баланса с его естественным антагонистом — IL-18-связывающим белком (interleukin-18 binding protein — IL-18BP), уровень которого снижен при остеопорозе, IL-18 может проявлять провоспалительные свойства. В таких условиях его действие способствует потере костной массы, что указывает на его потенциальную роль как мишени для терапии остеопороза [72]. IL-1β через активацию NF-κB и стимуляцию рецептора активатора ядерного фактора каппа-В (receptor activator of nuclear factor kappa-B ligand — RANKL) усиливает остеокластогенез и деградацию костной ткани. Кроме того, IL-1β может индуцировать воспалительный процесс в островках поджелудочной железы, что приводит к нарушению секреции инсулина, снижению пролиферации β-клеток и их апоптозу, способствуя развитию инсулинорезистентности [71, 73]. В противоположность этому, противовоспалительные цитокины, такие как IL-10, IL-4 и IL-13, оказывают преимущественно протективное действие на костную ткань [69]. IL-10 снижает активность провоспалительных цитокинов и подавляет резорбцию кости [66]. Высвобождение IL-4 и IL-13 в костной ткани способствует дифференцировке остеобластов и подавляет активность остеокластов, предотвращая потерю костной массы [74]. IL-22, в свою очередь, может усиливать провоспалительный ответ после травмы, подавляя регенерацию костной ткани за счет нарушения баланса цитокинов и ингибирования остеогенеза [75]. Адипокины также оказывают значительное влияние на метаболические процессы в костной ткани. Адипонектин, действуя через адренергическую β-сигнализацию, улучшает минерализацию кости, подавляет активность остеокластов и увеличивает экспрессию факторов роста, таких как FGF21, IL-15 и иризин, которые поддерживают костный гомеостаз [76, 77]. Лептин играет ингибирующую роль в отношении резорбции костной ткани, однако при ожирении его повышенные уровни могут способствовать деградации кости за счет дисбаланса между остео-бластами и остеокластами, а также увеличения уровня провоспалительных цитокинов [59]. Другие адипокины, включая резистин и висфатин, также модулируют дифференциацию остеобластов и/или остеокластов. Высокие уровни резистина в сыворотке связаны с низкой МПК [78]. Повышенный уровень висфатина стимулирует пролиферацию остеобластов и подавляет дифференцировку остеокластов в костной ткани через ингибирование экспрессии RANK, но у пациентов с воспалительными заболеваниями кишечника выявлена отрицательная корреляция концентрации висфатина с МПК [58, 79]. Несфатин-1, апелин и васпин обладают остеоанаболическими свойствами [57]. Химерин демонстрирует сложное двойственное влияние на костную ткань, проявляя как негативные, так и позитивные эффекты в зависимости от локализации и метаболического контекста. С одной стороны, повышенный при ожирении уровень циркулирующего химерина ассоциирован с остеопорозом через подавление Wnt (Wingless-related integration site) / β-катенинового пути и активацию RANKL/RANK-сигнализации, что усиливает остеокластогенез и резорбцию кости. С другой стороны, локальная продукция химерина в костном мозге стимулирует остеогенную дифференцировку мезенхимальных стволовых клеток через активацию протеинкиназы B / гликогенсинтазкиназы-3 β / β-катениновой (protein kinase B/ glycogen synthase kinase 3 beta/β Akt/Gsk3β) оси, что подтверждается увеличением костной массы у мышей с гиперэкспрессией химерина [80–82]. Также было показано, что у мышей повышение сывороточного уровня резолвина D1 стимулирует регенерацию костной ткани за счет двойного действия: подавления воспаления (снижение уровней IL-1β, TNF-α и активности остеокластов) и активации остеогенеза [83, 84]. Обобщенные данные о влиянии интерлейкинов и адипокинов на изменения КСТ представлены в таблице.


Заключение
Изменения КСТ, такие как саркопения, остеопения и ожирение, развиваются вследствие влияния множества факторов, в том числе сложного взаимодействия адипокинов и интерлейкинов, которые регулируют процессы воспаления, энергетического обмена и тканевого ремоделирования. Интерлейкины и адипокины формируют единую метаболическую ось нарушений, напрямую или опосредованно влияя на изменения КСТ, при этом являясь не строго специфичными. Вариабельность этих взаимодействий объясняет трудности в разработке терапевтических стратегий в профилактике и лечении избыточной массы тела, ожирения, саркопении и остеопороза. Поэтому является перспективным поиск новых лекарственных средств на основе метаболически активных цитокинов, которые смогут стать эффективными инструментами для профилактики и лечения патологических фенотипов КСТ.
Сведения об авторах:
Гизатуллина Регина Ринатовна — ассистент кафедры внутренних болезней и клинической психологии ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0003-1849-0469
Гафурьянова Эльмира Маратовна — ассистент кафедры внутренних болезней и клинической психологии ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0003-0344-3024
Жаманкулова Дамира Гиниятовна — д.м.н., доцент кафедры внутренних болезней Западно-Казахстанского медицинского университета имени Марата Оспанова; 030019, Казахстан, г. Актобе, ул. Маресьева, д. 68; ORCID iD 0000-0001-6943-0664
Тюрин Антон Викторович — д.м.н., доцент, заведующий кафедрой внутренних болезней и клинической психологии ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0002-0841-3024
Контактная информация: Гизатуллина Регина Ринатовна, e-mail: rina-sharipova@mail.ru
Прозрачность финансовой деятельности: исследование проведено при поддержке гранта РНФ № 24-25-00255.
Конфликт интересов отсутствует.
Статья поступила 09.04.2025.
Поступила после рецензирования 06.05.2025.
Принята в печать 02.06.2025.
About the authors:
Regina R. Gizatullina — Assistant Professor of the Department of Internal Medicine and Clinical Psychology, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0003-1849-0469
Elmira M. Gafuryanova — Assistant Professor of the Department of Internal Medicine and Clinical Psychology, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0003-0344-3024
Damira G. Zhamankulova — Dr. Sc. (Med.), Associate Professor of the Department of Internal Medicine, M. Ospanov West Kazakhstan Medical University; 68, Mareseva str., Aktobe, 030019, Kazakhstan; ORCID iD 0000-0001-6943-0664
Anton V. Tyurin — Dr. Sc. (Med.), Associate Professor, Head of the Department of Internal Medicine and Clinical Psychology, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0002-0841-3024
Contact information: Regina R. Gizatullina, e-mail: rina-sharipova@mail.ru
Financial Disclosure: the research was supported by the RSF grant No. 24-25-00255.
There is no conflict of interest.
Received 09.04.2025.
Revised 06.05.2025.
Accepted 02.06.2025.