Введение
Вирусные менингиты (ВМ) занимают ведущее место в структуре инфекционных заболеваний нервной системы. Ежегодная заболеваемость ВМ в мире составляет 11–15 случаев на 100 тыс. населения и определяется региональными и климатическими особенностями, ведением регистрации случаев заболевания, возможностями и качеством лабораторной диагностики [1–3].
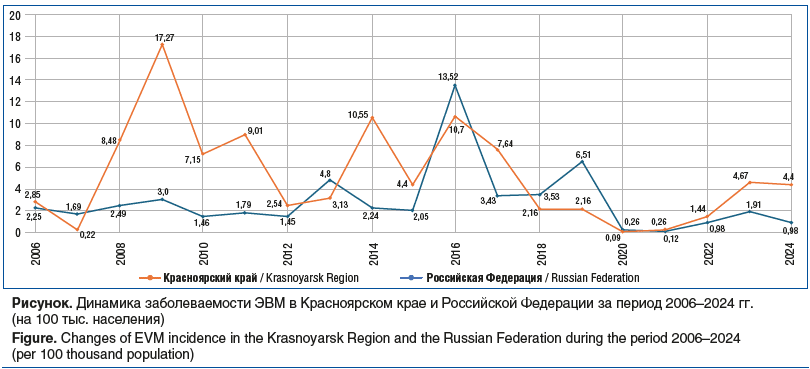
Наиболее частыми этиологическими факторами ВМ являются энтеровирусы (ЭВ), герпесвирусы, реже аденовирусы, вирусы кори, эпидемического паротита, гриппа, при этом первое место в этиологической структуре на протяжении многих лет занимают ЭВ [4]. Среди многообразия клинических форм энтеровирусной инфекции (ЭВИ) наиболее ургентными, требующими обязательной госпитализации в инфекционный стационар и нередко оказания неотложной медицинской помощи, являются варианты с поражением центральной нервной системы (ЦНС): асептические серозные менингиты, реже — энцефалиты, острые инфекционные миелопатии, синдром Гийена — Барре [1, 2, 5]. При этом показатель заболеваемости ЭВИ в Российской Федерации в 2024 г. составил 14,69 на 100 тыс. населения (21 491 случай), что в 1,5 раза превысило среднемноголетний показатель (СМП) и уровень 2023 г. (12,56 на 100 тыс. населения) на 17%. Несмотря на доминирование в структуре заболеваемости малых форм ЭВИ (везикулярный фарингит, экзантема), составляющих 93,3%, особое значение для системы здравоохранения имеют нейроинвазивные формы, требующие неотложного стационарного лечения. Среди них лидирующее положение занимает энтеровирусный менингит (ЭВМ). В 2024 г. в РФ зарегистрировано 1473 случая ЭВМ (показатель составил 0,98 на 100 тыс. населения), что в 2,5 раза ниже СМП и в 1,9 раза ниже уровня 2023 г.1.
Следует отметить, что уровень заболеваемости ЭВИ в Красноярском крае в 2024 г. в 2,1 раза превысил показатели заболеваемости по Российской Федерации (14,69 случая на 100 тыс. населения)2. На фоне многолетнего роста заболеваемости ЭВИ в Красноярском крае в 2024 г. зарегистрировано 119 случаев ЭВМ. Показатель заболеваемости составил 4,40 случая на 100 тыс. населения, что ниже уровня 2023 г. на 5,8%. При этом уровень заболеваемости ЭВМ в Красноярском крае в 4,5 раза превысил среднероссийский показатель (0,97 случая на 100 тыс. населения) (см. рисунок).
В возрастной структуре заболевших преобладают дети до 14 лет, на долю которых приходится от 63 до 75%, заболевают преимущественно дети в возрасте 5–9 лет (70–80%), организованные дети болеют в 2 раза чаще, чем неорганизованные2.
Развитие серозного менингита всегда свидетельствует о наличии иммунологического дефекта, как системного, так и локального, который либо генетически детерминирован, либо приобретен [5]. Несмотря на преобладание доброкачественного течения ЭВМ, более чем у 50% реконвалесцентов ЭВМ развивается выраженный интратекальный цитокиновый дисбаланс, избыточная активация иммунной системы приводит к гипервозбудимости нейронов головного мозга, снижению пластичности и жизнеспособности нервных клеток, обусловливая развитие когнитивных нарушений, что, в свою очередь, определяет актуальность совершенствования противовирусной терапии [6, 7].
На сегодняшний день хорошо известно, что наиболее выраженным противовирусным эффектом обладают ИФН I типа (ИФН-α, -β), блокирующие размножение ДНК/РНК-содержащих вирусов, независимо от их таксономического профиля [7].
Несмотря на многообразие лекарственных средств на основе ИФН, наибольшего внимания при лечении инфекционных заболеваний заслуживает препарат рекомбинантного ИФН альфа-2b с антиоксидантами Виферон® в форме суппозиториев для ректального применения, обладающий как иммуномодулирующим, так и прямым противовирусным действием. Антиоксиданты, входящие в состав данного препарата, — α-токоферола ацетат и аскорбиновая кислота оказывают стабилизирующее воздействие на клеточные мембраны, что позволяет увеличить противовирусную активность рекомбинантного ИФН альфа-2b в 10–14 раз, а также препятствовать массовой гибели клеток ЦНС и иммунной системы [8, 9].
Цель исследования: оценка терапевтической эффективности и безопасности применения препарата рекомбинантного ИФН альфа-2b c антиоксидантами в комплексной терапии ЭВМ у детей в возрасте от 4 до 17 лет.
Материал и методы
Проведено проспективное когортное нерандомизированное исследование по оценке терапевтической эффективности и безопасности использования препарата рекомбинантного ИФН альфа-2b c антиоксидантами, суппозитории ректальные, у 79 пациентов в возрасте от 4 до 17 лет, госпитализированных в инфекционный стационар КГБУЗ «КМДКБ № 1» с диагнозом «энтеровирусный менингит» в период с августа по сентябрь 2024 г.
Комплексное обследование на протяжении всего периода госпитализации пациентов включало изучение анамнеза заболевания и жизни, эпидемиологического анамнеза, анализ результатов лабораторных и инструментальных методов исследования, ежедневный осмотр больных инфекционистом, плановый осмотр неврологом и окулистом. При поступлении в стационар всем наблюдаемым пациентам проводилась диагностическая люмбальная пункция с последующим исследованием цереброспинальной жидкости (ЦСЖ). Контрольная люмбальная пункция для оценки динамики воспалительных изменений в ликворе и установления факта его санации проводилась через 14 сут после первой.
Энтеровирусная этиология менингита устанавливалась только на основании лабораторного подтверждения с использованием совокупности современных методов лабораторной диагностики: полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с определением РНК ЭВ в материале, взятом от больного (ликвор, венозная кровь, мазок из носоглотки, две пробы фекалий), а также серологического исследования3.
В составе комплексной терапии пациентам с ЭВМ традиционно назначалась дегидратационная, патогенетическая и другая симптоматическая терапия. В зависимости от назначения противовирусной терапии наблюдаемые больные были распределены на 2 группы.
Дети 1-й группы (n=41) в качестве этиотропной терапии получали препарат рекомбинантного ИФН альфа-2b с антиоксидантами, суппозитории ректальные, в возрастных дозах для лечения ВМ у детей согласно инструкции. Рекомбинантный ИФН альфа-2b с антиоксидантами назначался по 1 суппозиторию ректально 2 р/сут в течение первых 7 сут, а затем 1 р/сут на ночь в последующие 7 сут в дозах, зависящих от возраста пациента: c 4 до 11 лет включительно — по 1 000 000 МЕ, c 12 до 18 лет включительно — по 3 000 000 МЕ. Пациенты 2-й группы (контрольной) получали только патогенетическую и симптоматическую терапию. Больные обеих групп были сопоставимы по возрасту, срокам госпитализации в стационар, клиническим проявлениям и тяжести заболевания.
Эффективность проводимой терапии оценивалась по результатам клинических наблюдений, а именно: длительности сохранения основных клинических синдромов ЭВМ, результатам цитологического исследования ликвора и определению наличия или отсутствия выделения генетического материала ЭВ методом ПЦР на 14-е сутки с момента первой люмбальной пункции, а также по частоте полного клинического выздоровления к моменту выписки на 19–20-е сутки с момента госпитализации. Оценку без-опасности исследуемого препарата проводили путем фиксирования частоты и выраженности нежелательных реакций у пациентов, принимавших исследуемый препарат в составе комплексной терапии ЭВМ.
Статистическая обработка данных проводилась с использованием программного пакета Statistica 12.0 (StatSoft Inc., США). Нормальность распределения количественных признаков предварительно проверялась с помощью критерия Колмогорова — Смирнова. Поскольку все анализируемые количественные показатели соответствовали нормальному закону распределения (p>0,05), для сравнения двух независимых групп применялся двухвыборочный t-критерий Стьюдента. Сравнение качественных признаков проводилось с использованием критерия χ2 или точного критерия Фишера. Различия считались статистически значимыми при уровне p≤0,05. Данные количественных признаков представлены в виде M±m, где M — среднее арифметическое, m — стандартная ошибка средней, а также указан диапазон min–max (минимальное и максимальное значение).
Результаты и обсуждение
В возрастной структуре наблюдаемых больных ЭВМ в обеих группах преобладали дети от 4 до 11 лет — 81% (64/79), дети в возрасте 12–18 лет составили 19% (15/79). Гендерный анализ выявил преобладание мальчиков — 63,3% (50/79) над девочками — 36,7% (29/79). Различия при распределении внутри групп по возрасту и полу отсутствовали (табл. 1).


Большая часть детей — 69,6% (55/79) с ЭВМ доставлена в инфекционный стационар бригадами скорой медицинской помощи, 26,6% (21/79) пациентов осмотрены и направлены на госпитализацию участковым педиатром, и лишь 3,8% (3/79) детей доставлены в стационар родителями самостоятельно.
Изучение эпидемиологического анамнеза позволило установить, что в течение последних 7–10 дней у 30,4% (24/79) детей имел место контакт с больным членом семьи, 26,6% (21/79) пациентов посещали организованный коллектив, где регистрировались случаи ЭВИ, 43% (34/79) заболевших купались в открытых водоемах, бассейнах.
На момент госпитализации с учетом выраженности клинических проявлений всем пациентам была диагностирована среднетяжелая степень ЭВМ. Клиническая картина заболевания у большинства наблюдаемых больных традиционно характеризовалась развитием интоксикационного, общемозгового и менингеального синдромов. Общемозговой синдром включал в себя головную боль (88,6%, 70/79), рвоту (94,9%, 75/79), светобоязнь (70,9%, 56/79). Главным проявлением интоксикационного синдрома являлась лихорадка, чаще фебрильного (77,2%, 61/79), реже — субфебрильного характера (26,6%, 21/79). Особенностью менингеального синдрома являлась диссоциация менингеальных знаков у 78,5% (62/79) больных, положительный симптом Манна — Гуревича выявлен в 91,1% (72/79) случаев. Необходимо отметить, что у большинства пациентов на момент поступления в стационар имели место и другие патогномоничные для ЭВИ симптомы: поражение слизистой оболочки глаз в виде склерита и конъюнктивита (86,1%, 68/79), гиперемия, зернистость и бугристость задней стенки глотки (77,2%, 61/79), мышечные боли и боли в животе (16,5%, 13/79), увеличение размеров печени (29,1%, 23/79).
При исследовании клинического анализа крови у 87,3% (69/79) детей отмечался лейкоцитоз, причем количество лейкоцитов выше 15×109/л регистрировалось лишь у 21,7% (15/69). Изменения в лейкоцитарной формуле у подавляющей части пациентов (86,1%, 68/79) имели нейтрофильный характер, что также является особенностью менингита энтеровирусной этиологии [5].
Люмбальная пункция с проведением цитологического исследования ликвора проводилась на 1–2-й день с момента госпитализации ребенка в стационар и характеризовалась изменениями, свойственными серозному менингиту. Средние значения плеоцитоза составили 175–200 клеток (кл) /мкл с минимальным значением 25 кл/мкл и максимальным значением 892 кл/мкл (табл. 2). Средний показатель общего белка в ликворе составил 460,25±14,17 г/л с максимальным и минимальным значениями 802 и 213 г/л соответственно.

Следует отметить, что лимфоцитарный характер плеоцитоза отмечался в 48,1% (38/79) случаев, доля нейтрофилов преобладала в 16,5% (13/79) проб ликвора, смешанный характер плеоцитоза отмечался у 35,4% (28/79) больных, что также является характерными изменениями в ЦСЖ у детей с ЭВМ [5].
Этиология ЭВИ была установлена обнаружением РНК ЭВ методом ПЦР в ликворе у 87,3% (69/79) наблюдаемых больных. В остальных случаях этиология была подтверждена одновременным обнаружением РНК ЭВ в двух нестерильных средах: смывах из ротоглотки и фекалиях (12,7%; 10/79), что согласуется с современными регламентирующими документами3.
Изучение терапевтической эффективности препарата рекомбинантного ИФН альфа-2b с антиоксидантами проведено на основании сравнительной оценки продолжительности основных клинических синдромов ЭВМ у наблюдаемых пациентов обеих групп. При статистической обработке данных были установлены достоверные различия в группах, свидетельствующие, что назначение ИФН альфа-2b больным 1-й группы позволило сократить продолжительность клинических синдромов заболевания в сравнении со 2-й группой пациентов. Так, у больных ЭВМ 1-й группы средняя продолжительность менингеального синдрома составила 5,2±0,19 дня, а во 2-й группе — 6,1±0,29 дня (p=0,004208), синдром интоксикации у больных 1-й группы сохранялся 1,71±0,16 дня, тогда как у детей 2-й группы его продолжительность составляла 2,3±0,14 дня (p=0,004677). Купирование общемозгового синдрома на фоне терапии ИФН альфа-2b в 1-й группе в среднем происходило через 3,76±0,14 дня, тогда как во 2-й группе общемозговые симптомы сохранялись на протяжении 4,65±0,21 дня (p=0,0001) (табл. 3).

Наряду с купированием основных клинических синдромов ЭВМ на фоне проводимой терапии при цитологическом исследовании ЦСЖ, полученной при проведении контрольной люмбальной пункции у наблюдаемых пациентов обеих групп на 14-е сутки, происходило значительное снижение плеоцитоза — в среднем в 15–40 раз. Однако при сравнительном изучении полученных данных средний показатель плеоцитоза в 1-й группе оказался достоверно ниже, чем во 2-й группе. Так, у детей 1-й группы показатель плеоцитоза составил 4,02±0,5 кл/мкл, а во 2-й группе он был значительно выше — 13,65±6,1 кл/мкл (p=0,000242), что свидетельствует о сохраняющихся воспалительных изменениях в ЦСЖ у ряда пациентов на фоне стандартной терапии (табл. 4).

Повторное молекулярно-биологическое исследование ликвора у наблюдаемых больных ЭВМ позволило установить, что у всех детей 1-й группы РНК ЭВ в ликворе не была обнаружена, что говорит о его полной санации, тогда как у детей 2-й группы генетический материал ЭВ был обнаружен в 10,5% случаев.
Известно, что, несмотря на благоприятное течение ЭВМ, возможно выздоровление с остаточными явлениями в виде развития цереброастенического, гипертензионного синдромов, очаговой микросимптоматики, синдрома гипоталамической дисфункции, что в ряде случаев требует дальнейшего продолжения терапии [2, 3, 5].
К моменту выписки из стационара (19–21-е сутки от госпитализации) у 78,0% (32/41) больных ЭВМ 1-й группы имело место полное клиническое выздоровление, в то время как у детей 2-й группы клиническое выздоровление отмечалось в 1,6 раза реже (50,0%, 19/38), что являлось основанием для продолжения наблюдения и лечения в амбулаторных условиях.
С целью оценки безопасности применения препарата рекомбинантного ИФН альфа-2b с антиоксидантами у наблюдаемых больных ЭВМ в период пребывания в условиях стационара учитывалась частота развития нежелательных явлений. В процессе наблюдения в 1-й группе пациентов нежелательных явлений выявлено не было, что позволило считать применение рекомбинантного ИФН альфа-2b с антиоксидантами (Виферон®) при ЭВМ у детей 4–17 лет безопасным.
Накоплен большой опыт применения препарата рекомбинантного ИФН альфа-2b с антиоксидантами с учетом его механизма противовирусного и иммуномодулирующего действия, доказанной эффективностью и безопасностью в терапевтически эффективных дозах и различных формах (суппозитории, гель, мазь) и комбинациях при вирусных инфекциях, в том числе ВМ и энцефалитах, COVID-19 у детей и беременных как с целью лечения, так и с целью профилактики [10–15].
Заключение
Таким образом, ЭВМ является актуальной проблемой практической педиатрии, характеризуется повсеместным распространением, сезонностью, полиморфизмом клинических проявлений, возможным развитием когнитивных дисфункций в периоде реконвалесценции, что требует не только поиска маркеров, определяющих тяжесть интратекального повреждения, но и совершенствования противовирусной терапии.
Недостаточная эффективность системы ИФН при инфекциях и нейроинфекциях может иметь как генетические наследственные причины, так и определяться свойствами вирусов и их способностью блокировать синтез и реализацию функций ИФН на разных этапах инфекционного процесса, что, безусловно, является основанием для широкого использования препаратов рекомбинантного ИФН альфа-2b в комплексной терапии пациентов.
В настоящее время ИФН альфа-2b с антиоксидантами широко применяется на практике, в том числе при ВМ и энцефалитах, COVID-19 у детей и беременных, как с целью лечения, так и с целью профилактики.
Результаты настоящего исследования по изучению эффективности и безопасности применения исследуемого препарата позволили установить достоверное сокращение продолжительности основных клинических синдромов ЭВМ в среднем на 1–2 дня (p≤0,05), ускорение регресса воспалительных изменений в ликворе (в 3,4 раза снижались средние значения плеоцитоза с полной санацией ликвора в 100% случаев), что обеспечило полное клиническое выздоровление у 78,0% (32/41) пациентов 1-й группы. Доказанные эффективность и безопасность препарата рекомбинантного ИФН альфа-2b с антиоксидантами в составе комплексной терапии среднетяжелых форм ЭВМ у детей 4–17 лет являются основанием для его широкого внедрения в практику терапии ЭВМ.
СВЕДЕНИЯ ОБ АВТОРАХ:
Мартынова Галина Петровна — д.м.н., профессор, заслуженный врач РФ, заслуженный работник высшей школы РФ, заведующая кафедрой детских инфекционных болезней с курсом ПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-2014-0698
Злобин Данил Викторович — аспирант кафедры детских инфекционных болезней с курсом ПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0009-0004-8873-6764
Нахмурова Ирина Александровна — к.м.н., доцент кафедры детских инфекционных болезней с курсом ПО ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-7055-6683
Андреева Алена Александровна — к.м.н., заведующая отделением нейроинфекций КГБУЗ «КМДКБ № 1»; 660014, Россия, г. Красноярск, ул. Тельмана, д. 49; ORCID iD 0000-0002-2973-5620
Карасев Александр Валерьевич — заведующий инфекционным стационаром КГБУЗ «КМДКБ № 1»; 660014, Россия, г. Красноярск, ул. Тельмана, д. 49; ORCID iD 0000-0002-1747-3619
Леонова Ирина Владимировна — врач-невролог инфекционного стационара КГБУЗ «КМДКБ № 1»; 660014, Россия, г. Красноярск, ул. Тельмана, д. 49.
Контактная информация: Мартынова Галина Петровна, e-mail: doc-martynova@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.06.2025.
Поступила после рецензирования 04.07.2025.
Принята в печать 29.07.2025.
ABOUT THE AUTHORS:
Galina P. Martynova — Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, Honored Worker of Higher Education of the Russian Federation, Head of the Department of Pediatric Infectious Diseases with a Postgraduate Course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-2014-0698
Danil V. Zlobin — postgraduate student of the Department of Pediatric Infectious Diseases with a Postgraduate Course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0009-0004-8873-6764
Irina A. Nakhmuurova — C. Sc. (Med.), Associate Professor, Department of Pediatric Infectious Diseases with a Postgraduate Course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-7055-6683
Alena A. Andreeva — C. Sc. (Med.), Head of the Department of Neuroinfection, Krasnoyarsk Interdistrict Children’s Clinical Hospital No. 1; 49, Telmana str., Krasnoyarsk, 660014, Russian Federation; ORCID iD 0000-0002-2973-5620
Alexander V. Karasev — Head of the Inpatient Department of Infectious Diseases, Krasnoyarsk Interdistrict Children’s Clinical Hospital No. 1; 49, Telmana str., Krasnoyarsk, 660014, Russian Federation; ORCID iD 0000-0002-1747-3619
Irina V. Leonova — neurologist of the Inpatient Department of Infectious Diseases, Krasnoyarsk Interdistrict Children’s Clinical Hospital No. 1; 49, Telmana str., Krasnoyarsk, 660014, Russian Federation.
Contact information: Galina P. Martynova, e-mail: doc-martynova@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.06.2025.
Revised 04.07.2025.
Accepted 29.07.2025.
1О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2024 году: Государственный доклад. (Электронный ресурс.) URL: https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=30171 (дата обращения: 03.06.2025).
2О состоянии санитарно-эпидемиологического благополучия населения в Красноярском крае в 2024 году: Государственный доклад. (Электронный ресурс.) URL: http://www.mpr.krskstate.ru/envir/page5849 (дата обращения: 03.06.2025).
3Санитарные правила и нормы СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» (утверждены постановлением Главного государственного санитарного врача Российской Федерации от 28 января 2021 г. № 4).