Введение
Ожирение в настоящее время представляет собой одну из основных медико-социальных проблем и имеет тенденцию к неуклонному росту его распространенности. Наряду с сахарным диабетом 2 типа (СД2) ожирение рассматривается как одно из ключевых неинфекционных заболеваний, лежащих в основе развития ранних осложнений и смерти, прежде всего, от сердечно-сосудистых причин. По данным Международной федерации по борьбе с ожирением, опубликованным в 2024 г., в настоящее время в мире насчитывается около 880 млн взрослых и до 160 млн детей и подростков в возрасте от 5 до 19 лет, страдающих ожирением1. В 2025 г. в World Obesity Atlas были систематизированы эпидемиологические данные о распространенности ожирения и спрогнозирован рост числа больных с индексом массы тела (ИМТ), превышающим нормальные значения, к 2030 г. до 3 млрд2.
Хорошо известно, что ожирение, и прежде всего абдоминальное, связано с рядом метаболических расстройств, таких как нарушения углеводного, липидного и пуринового обмена, метаболически ассоциированная жировая болезнь печени (МАЖБП), синдром обструктивного апноэ сна. Кроме того, избыточная масса тела и ожирение являются независимыми факторами риска развития желчнокаменной болезни, остеоартрита, а также злокачественных новообразований различных локализаций [1]. В последние годы все больше внимания уделяется проблеме взаимосвязи сердечно-сосудистых заболеваний (ССЗ), в частности артериальной гипертензии (АГ), ишемической болезни сердца, острого и хронического нарушения мозгового кровообращения, с ожирением. Так, по данным World Obesity Atlas, к 2025 г. более 1,5 млн случаев ранней смерти, прежде всего от сердечно-сосудистых причин, было ассоциировано с избыточной массой тела или ожирением2. Еще одной важной проблемой современной медицины является негативное воздействие ожирения на репродуктивную функцию, в том числе на возможность наступления естественной беременности, и эффективность вспомогательных репродуктивных технологий (ВРТ).
По данным Всемирной организации здравоохранения, бесплодием страдает около 17,5% взрослого населения мира, что означает, что с этой проблемой сталкивается каждый шестой человек репродуктивного возраста [2]. Выделяют женское, мужское и комбинированное бесплодие. Причины бесплодия многообразны. Среди ключевых со стороны женского организма рассматриваются нарушение овуляторной функции, проходимости маточных труб, наличие эндометриоза, а также состояния, связанные со структурными изменениями в шейке и теле матки, препятствующие имплантации эмбриона. Отдельно выделяют группу гормональных изменений, негативно влияющих на наступление беременности [3]. В настоящее время ожирение признано независимым фактором риска нарушения репродуктивной функции. Так, эпидемиологическое исследование, проведенное в США, показало, что среди женщин с бесплодием в возрасте от 20 до 44 лет более 40% имеют ожирение [4].
Ожирение и репродуктивные нарушения
Негативное влияние избыточной массы тела и ожирения на репродуктивную функцию сводится к нескольким ключевым аспектам. Одной из наиболее частых причин бесплодия у женщин с ожирением является ановуляторный менструальный цикл. Так, результаты проведенных исследований показали, что вероятность ановуляторного бесплодия у женщин с ИМТ ≥32 кг/м2 более чем вдвое выше, чем у женщин с нормальной массой тела [5, 6]. Проблема ановуляции при избытке или, напротив, дефиците массы тела является предметом изучения в течение многих лет. J.W. Rich-Edwards et al. [7] описали U-образную кривую ассоциации нарушения овуляции с ИМТ у женщин в Северной Америке, где риск ановуляторного цикла повышался при ИМТ менее 20 и более 24 кг/м2. Известно, что при ожирении наблюдается повышение активности ароматазы, приводящей к усиленному синтезу эстрогенов в абдоминальной жировой ткани и, следовательно, относительному их дефициту и, напротив, избытку андрогенов овариального генеза. В совокупности с развивающейся инсулинорезистентностью эти процессы могут быть причиной формирования вторичных поликистозных изменений в яичниках как этиологического фактора бесплодия, сопровождающегося ановуляцией [8].
Одним из важных звеньев патогенеза нарушения фертильности при ожирении является адипозопатия. Ключевыми адипоцитокинами, вовлеченными в регуляцию репродуктивной функции, являются адипонектин, лептин, грелин и хемерин [9].
Адипонектин обладает протективным потенциалом, способствуя улучшению чувствительности тканей к инсулину, положительно влияя на липидный обмен, оказывая антиатерогенное действие [10]. В то же время выработка данного адипоцитокина снижается при ожирении [11], что нарушает секрецию половых стероидов и негативно влияет на фолликулогенез [12]. Рецепторы к адипонектину экспрессируются в органах репродуктивной системы, прежде всего в яичниках, эндометрии, а также в плаценте, а снижение их экспрессии может ассоциироваться с рецидивирующими нарушениями имплантации эмбриона. Выявлена высокая плотность адипонектиновых рецепторов в аркуатных и паравентрикулярных ядрах гипоталамуса. В гипофизе адипонектин подавляет выработку лютеинизирующего гормона (ЛГ) [13].
Действие лептина, другого важного адипоцитокина, участвующего в регуляции энергетического баланса, реализуется на уровне центральной нервной системы, преимущественно гипоталамуса, где он подавляет аппетит и, главным образом, модулирует секрецию ЛГ и фолликулостимулирующего гормона (ФСГ) [14]. В то же время лептин является регулятором функционирования гипоталамо-гипофизарно-яичниковой оси, влияя на наступление менархе, имплантацию эмбриона при наступлении беременности и само течение беременности [15]. Кроме того, лептин способен оказывать прямой эффект на яичники в виде ингибирующего влияния на развитие фолликулов и созревание ооцита посредством взаимодействия со своими рецепторами на поверхности фолликулов. Таким образом, повышенный уровень лептина в сочетании с лептинорезистентностью при ожирении может играть важную роль в нарушении фертильности [16] и рассматриваться в качестве дополнительного предиктора нарушения со стороны репродуктивной системы у женщин с ожирением, планирующих беременность [17].
Уровень грелина — гормона, ответственного за усиление потребления пищи и накопление жировой ткани, чаще всего снижается при ожирении [18]. Он регулирует высвобождение гонадотропин-рилизинг-гормона (ГнРГ), который, в свою очередь, индуцирует секрецию ФСГ и ЛГ [19]. Нарушение функционирования данной оси при ожирении, на фоне дефицита грелина, может являться одним из механизмов снижения фертильности. Во время беременности грелин оказывает стимулирующее действие на пролиферацию клеток плаценты, одновременно подавляя апоптоз в этих клетках, и способен подавлять сократительную деятельность матки, что может играть роль при сохранении беременности [20].
В последние годы обсуждается также роль нового адипоцитокина — хемерина в регуляции репродуктивной функции. Данный гормон принимает участие в дифференцировке адипоцитов, и при его повышении наблюдается развитие асептического воспаления в жировой ткани. Известно, что высокий уровень хемерина ассоциирован со снижением секреции ФСГ [16]. Таким образом, дисбаланс адипоцитокинов в условиях ожирения оказывает непосредственное влияние на репродуктивную функцию.
Ожирение может оказывать воздействие на структуру и функцию фолликулов и через ряд других механизмов. Так, процесс липолиза влияет на состав неэстерифицированных жирных кислот в фолликулярной жидкости [21]. Известно, что женщины с высоким ИМТ имеют повышенный уровень олеиновой и стеариновой кислот в фолликулярной жидкости, что может приводить к фрагментации эмбриона [13, 16]. Ооциты при ожирении имеют более низкий уровень омега-3 полиненасыщенных жирных кислот по сравнению с ооцитами женщин с нормальной массой тела, что также негативно влияет на реализацию репродуктивной функции [22].
Несмотря на распространенную рекомендацию по снижению массы тела в рамках прегравидарной подготовки у женщин с ожирением, результаты проведенных исследований остаются весьма противоречивыми. С одной стороны, результаты когортных исследований свидетельствуют о снижении риска акушерских осложнений, включая гестационный СД, преэклампсию и эклампсию, а также преждевременные роды, на фоне нормализации массы тела до наступления беременности [23, 24]. D.C. Gesink Law et al. [25] описали положительный эффект в виде повышения вероятности наступления беременности независимо от регулярности менструального цикла, паритета, статуса курения и возраста женщин при нормализации массы тела. В рамках рандомизированных контролируемых исследований (РКИ) снижение массы тела на 5–7% от исходного у женщин с бесплодием приводило к повышению частоты наступления спонтанной беременности и улучшению овуляторной функции [26]. С другой стороны, ряд исследователей не подтвердили таких ассоциаций [27]. Метаанализ, объединивший данные 16 РКИ (n=3588), показал, что, хотя снижение массы тела и повышает вероятность наступления беременности, оно не оказывает значимого влияния на частоту живорождений (относительный риск (ОР) 1,19) или выкидышей (ОР 1,17) [28].
Таким образом, избыточная масса тела и ожирение являются важными факторами риска развития и прогрессирования репродуктивных нарушений, что требует комплексного подхода к лечению этих больных в рамках прегравидарной подготовки.
Современные аспекты медикаментозного лечения ожирения
В соответствии с клиническими рекомендациями, принятыми в Российской Федерации в 2024 г.3, лечение ожирения должно включать в себя стратегию изменения образа жизни, в том числе питания и физической активности, а также медикаментозную терапию. Последняя рекомендована пациентам с ИМТ ≥30 кг/м2, а также при ИМТ ≥27 кг/м2 при наличии факторов риска и/или коморбидных заболеваний, таких как дислипидемия, нарушения углеводного обмена, АГ и другие ССЗ или синдром обструктивного апноэ сна. Среди лекарственных средств для лечения ожирения рассматриваются ингибитор желудочно-кишечной липазы орлистат, ингибитор обратного захвата серотонина, норадреналина и допамина сибутрамин, а также агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) различной продолжительности действия лирагутид и семаглутид. Агонисты рецепторов ГПП-1 (арГПП-1) первоначально были одобрены для лечения СД2, однако в последние годы у ряда представителей данного класса, в частности у лираглутида и семаглутида, появились высокодозированные формы, зарегистрированные для лечения ожирения, даже в отсутствие нарушений углеводного обмена. В настоящее время появляется все больше данных о многообразных плейотропных эффектах арГПП-1, в частности о кардиопротективном [29], нефропротективном [30], нейропротективном действии [31, 32], а также об их положительном влиянии на течение МАЖБП [33]. Появление вначале за рубежом, а затем и в Российской Федерации двойных агонистов рецепторов ГПП-1 и глюкозозависимого инсулинотропного пептида (ГИП), или твинкретинов, расширяет диапазон положительных эффектов данного класса препаратов. Твинкретины, в частности тирзепатид, входят в рекомендации по лечению ожирения, принятые Канадским обществом по борьбе с ожирением совместно с Обществом бариатрических хирургов (2025)4, Американской ассоциацией клинической эндокринологии совместно с Американской диабетологической ассоциацией (2025)5, а также одобрены Европейским медицинским агентством (ЕМА)6.
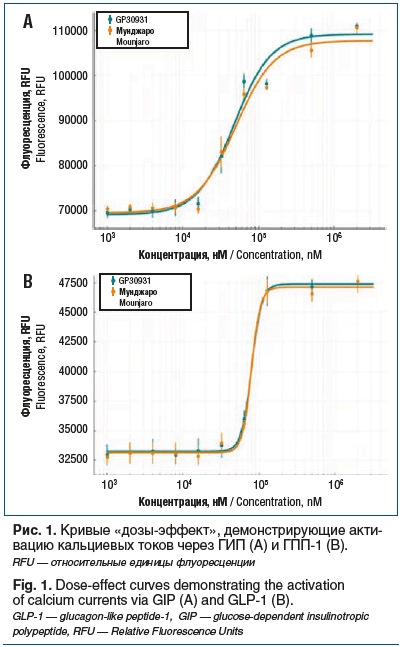
С учетом высокой распространенности ожирения среди женского населения РФ вопрос доступа к терапии тирзепатидом является актуальным для пациентов в РФ. Следует отметить, что оригинальный препарат тирзепатида (Мунджаро), официально в РФ и ЕАЭС не зарегистрирован, что послужило стимулом для отечественных фармацевтических компаний к разработке собственных дженериков препарата. Компанией «ГЕРОФАРМ» тирзепатид под торговым наименованием Седжаро® был зарегистрирован в 2025 г. Комплекс проведенных исследований с использованием ортогональных методов показал, что Седжаро® и Мунджаро структурно идентичны, сопоставимы по профилю примесей и биологически эквивалентны (рис. 1) [34].

В соответствии с клиническими рекомендациями по лечению ожирения, принятыми в России, критерием эффективности снижения массы тела является потеря не менее 5% от исходной за 3 мес. Однако рассматривается и более интенсивное снижение массы тела, в частности при наличии ассоциированных с ожирением заболеваний. Так, например, при наличии у пациента СД2, дислипидемии, АГ рекомендована потеря до 15% массы тела4. С появлением твинкретинов данная задача реализуется проще. Известно, что клинический эффект тирзепатида превосходит таковой у семаглутида. В мае 2025 г. были опубликованы результаты сравнительного исследования, показавшие, что терапия тирзепатидом в течение 18 мес. ассоциирована со снижением массы тела на 20,2%, в то время как применение семаглутида приводило к потере 13,7% массы тела [35].
Важным аспектом терапии инкретиномиметиками представляется схема отмены данного класса препаратов. Принимая во внимание тот факт, что ожирение сегодня рассматривается как хроническое рецидивирующее заболевание, ключевой проблемой представляется повторный набор массы тела после завершения терапии. Так, в исследованиях STEP 1–4 через 1 год после отмены семаглутида в дозе 2,4 мг участники вернули около 2/3 потерянной массы [36, 37]. Аналогичные данные были получены и для тирзепатида в исследовании SURMOUNT-4 [38].
С другой стороны, согласно исследованию TAILGATE, постепенное снижение дозы семаглутида (с 2,4 мг до полной отмены с шагом в 2 нед.) в сочетании с модификацией образа жизни через 6 мес. после полной отмены препарата позволило 80% пациентов сохранить достигнутый результат [39]. Аналогичные данные в отношении долгосрочного удержания массы тела получены и в другом исследовании при постепенном снижении кратности применения арГПП-1 [40]. Российские эксперты также предполагают, что постепенная отмена терапии показывает преимущество перед одномоментным прекращением использования арГПП-1 и твинкретинов для долгосрочного удержания массы тела [41].
Эффекты арГПП-1 и арГИП в отношении репродуктивной системы
Принимая во внимание не только высокую распространенность метаболических нарушений, но и значительный интерес к преодолению проблемы бесплодия, необходимо подробнее остановиться на потенциальных эффектах инкретиномиметиков в отношении женской репродуктивной системы.
Как известно, эффекты арГПП-1 и арГИП на репродуктивную систему могут реализовываться посредством как минимум двух механизмов. Одним из них является снижение массы тела и связанные с этим благоприятные эффекты данного класса препаратов, другим эффектом может рассматриваться прямое влияние на гипоталамо-гипофизарно-яичниковую ось (рис. 2).

Показано, что терапия инкретиномиметиками оказывает благоприятное действие на проявления адипозопатии. В частности, применение как арГПП-1, так и твинкретинов приводит к повышению уровня адипонектина [42, 43], снижению уровня лептина [44, 45] и уменьшению провоспалительного статуса в жировой ткани. Кроме того, снижение массы тела на фоне терапии инкретиномиметиками приводит не только к нормализации секреции инсулина β-клетками и улучшению показателей углеводного и липидного обмена, но и к снижению синтеза андрогенов яичниками, а также восстановлению пульсовой секреции ГнРГ [46]. Такие гормональные изменения, в свою очередь, способствуют нормализации менструального цикла и восстановлению овуляторной функции [47]. Так, результаты опубликованного метаанализа, включившего данные 11 РКИ (n=840), показали, что терапия арГПП-1 значимо повышала частоту наступления естественной беременности и улучшала регулярность менструаций, а также ассоциировалась с выраженным улучшением метаболических показателей [48].
Согласно данным экспериментальных исследований наличие рецепторов ГПП-1 (рГПП-1) в органах репродуктивной системы, включая гипоталамус, гипофиз, яичники и эндометрий [49], позволяет предположить прямое воздействие инкретиномиметиков на гипоталамо-гипофизарно-гонадную ось. Так, исследования in vitro показали, что арГПП-1, связываясь с одноименными рецепторами, стимулируют нейроны, секретирующие ГнРГ, а также оказывают модулирующее влияние на kisspeptin-нейроны (Kiss-1), приводя к нормализации секреции ФСГ и ЛГ аденогипофизом [48, 50, 51].
Необходимо отметить еще один важный факт, свидетельствующий об экспрессии рГПП-1 на клетках гранулезы яичников [52]. Дополнительно, экзогенное введение арГПП-1 крысам с индуцированным СД2 приводило к уменьшению стромального фиброза яичников, а также к повышению уровня антимюллерова гормона в сыворотке, что может косвенно свидетельствовать о существовании прямой связи между инкретиновым сигнальным путем и овариальной функцией [53].
Отмечено влияние арГПП-1 на эндометрий. Согласно результатам, представленным в обзоре A. Sola-Leyva et al. [54], арГПП-1 индуцируют аутофагию, уменьшение апоптоза и фиброза эндометрия в моделях на животных. Данные эффекты реализуются за счет уменьшения оксидативного стресса и подтверждают гипотезу о положительном эффекте арГПП-1 на рецептивность эндометрия.
Учитывая все вышесказанное, следует отметить, что число исследований по оценке связи между снижением массы тела на фоне применения инкретиномиметиков и улучшением показателей фертильности в настоящее время довольно ограничено.
Практические аспекты терапии инкретиномиметиками в репродуктивном периоде
Использование арГПП-1 и двойных арГПП/ГИП у женщин репродуктивного возраста нередко сопряжено с приемом комбинированных оральных контрацептивов (КОК), в связи с чем представляется актуальным вопрос их совместного использования. Так, в соответствии с рекомендациями FDA (Food and Drug Administration), были проведены фармакокинетические исследования по взаимодействию арГПП-1 (эксенатид, лираглутид, семаглутид и др.) с КОК. Было показано, что арГПП-1 несколько замедляют опорожнение желудка, что может приводить к более медленному всасыванию последних. В частности, при сочетанном использовании наблюдается снижение пиковой концентрации (Cmax) и задержка времени ее достижения (tmax) у КОК. В то же время ключевой показатель — общая экспозиция (AUC) — как для этинилэстрадиола, так и для прогестагенов, входящих в состав КОК, остается неизменным. Таким образом, согласно результатам систематического обзора B. Calvarysky et al. [55], при совместном приеме с арГПП-1 и КОК биодоступность последних не претерпевает значимых изменений, и лекарственное взаимодействие данных групп препаратов представляется маловероятным. В то же время все больше появляется данных о замедлении всасывания и, как следствие, снижении эффективности КОК на фоне использования твинкретинов. Указанный эффект преимущественно описан для тирзепатида и в большей степени проявляется при инициации терапии и в период титрации дозы [56]. Показано, что замедление всасывания КОК может сохраняться до 4 нед. после последнего введения арГПП-1/ГИП [57]. В связи с этим обсуждается необходимость использования дополнительной барьерной контрацепции на период применения инкретиномиметиков [56]. В ряде случаев целесообразно использовать внутриматочную контрацепцию.
На сегодняшний день предметом активной дискуссии является вопрос оптимальной длительности и сроков отмены терапии арГПП-1 и арГПП-1/арГИП на этапе прегравидарной подготовки. В связи с неуточненным тератогенным риском производители рекомендуют использовать надежные методы контрацепции на период применения данного класса препаратов, а также планировать их отмену заблаговременно до предполагаемого срока наступления беременности [26]. Временной диапазон отмены в большей степени обусловлен особенностями фармакокинетики и скоростью выведения препаратов. Так, например, в инструкции к семаглутиду на ресурсе РЛС (Регистр лекарственных средств России) указано, что он обнаруживается в организме в течение 5 нед. после введения последней дозы. С учетом этих данных, согласно международным рекомендациям, введение арГПП-1 и твинкретинов (лираглутида, семаглутида, тирзепатида) необходимо прекратить за 8 нед. до планируемой беременности. В некоторых европейских странах, в частности в Великобритании, в инструкции к тирзепатиду можно видеть рекомендации по отмене препарата за 4 нед. до наступления беременности. Однако на сегодняшний день данные рекомендации единичны.
Таким образом, требуется проведение дополнительных исследований с целью получения новых данных для уточнения сроков отмены на этапе прегравидарной подготовки. В настоящее время в РФ необходимо использовать временной промежуток в 8 нед. до наступления беременности для отмены данного класса препаратов. Принимая во внимание возможное увеличение массы тела при отмене инкретиномиметиков и нередко ограниченные сроки подготовки к ВРТ, особенно у женщин позднего репродуктивного возраста, возникает необходимость мультидисциплинарного подхода и создания рекомендаций по использованию арГПП-1 и твинкретинов при подготовке женщины к наступлению беременности.
Применение во время беременности и лактации
На сегодняшний день арГПП-1 и твинкретины относятся к категории C по FDA, в связи с чем их применение не рекомендуется во время беременности. Данное предостережение основано на результатах доклинических исследований на животных, которые указывают на повышенный риск прерывания беременности на ранних сроках, снижения массы тела, а также увеличения частоты скелетных аномалий и пороков развития внутренних органов у плода. Являются ли данные эффекты следствием прямого фармакологического воздействия препарата или энергетического дефицита, ассоциированного с ограничением питания и снижением массы тела, остается не до конца ясным.
В настоящее время накапливаются данные о случайном применении арГПП-1/арГИП в I триместре беременности. Так, в регистрационных исследованиях семаглутида (SUSTAIN, STEP) было зафиксировано 46 случаев кратковременного воздействия препарата до подтверждения беременности. Среди них зафиксирован лишь один случай аномалии развития наружного уха у новорожденного, другого подтвержденного тератогенного эффекта или случаев прерывания беременности установлено не было. Результаты крупного исследования, опубликованные в 2023 г. (n=461), также не выявили значимого повышения риска мальформаций на фоне применения арГПП-1 в I триместре беременности [58]. Аналогичные данные были представлены в обсервационном исследовании: показана невысокая вероятность неблагоприятных исходов для плода при случайном применении арГПП-1 в I триместре беременности [59]. Однако важно учитывать отдельные сообщения о потенциальных рисках такой терапии. Так, в литературе описан случай макросомии плода, которую исследователи связали с «рикошетной прибавкой массы тела» после отмены семаглутида [60]. На ежегодной конференции SMFM-2025 были представлены результаты крупного анализа, включавшего данные о течении и исходах беременности у 4,6 млн женщин с СД2, которые показали, что у пациенток, получавших семаглутид, несмотря на снижение риска преждевременных родов на 26%, наблюдалось увеличение вероятности развития преэклампсии, синдрома HELLP и эклампсии по сравнению с женщинами, которые не получали арГПП-1.
Данные о применении инкретиномиметиков в период лактации носят противоречивый характер. Учитывая, что арГПП-1/ГИП представляют собой крупные белковые молекулы, их секреция в грудное молоко в больших концентрациях маловероятна, а небольшое количество препарата, попадающее новорожденному при грудном вскармливании, должно подвергаться деградации под действием протеаз желудочно-кишечного тракта. Тем не менее в связи с отсутствием данных о безопасности применения инкретиномиметиков в период лактации рекомендуется избегать назначения данной группы препаратов кормящим женщинам [61].
Следует помнить еще об одной важной составляющей терапии аргПП-1 и арГИП в период подготовки к беременности, а именно использовании инкретинов при малоинвазивных гинекологических вмешательствах. Так, забор ооцитов или гистероскопия в рамках программ прегравидарной подготовки, в том числе с применением ВРТ, все чаще имеет место в клинической практике. Согласно современным рекомендациям и международным консенсусам, как арГПП-1, так и твинкретины следует отменять за 7 дней до плановой процедуры, требующей анестезиологического пособия, в связи с риском замедления опорожнения желудка и отсутствием однозначных данных о риске аспирации [26, 62].
Заключение
Накопленные на сегодняшний день научные и клинические данные позволяют констатировать высокую распространенность ожирения и его негативное влияние на репродуктивное здоровье женщин. Среди современных медикаментозных методов коррекции ожирения лидирующую позицию занимают арГПП-1 и твинкретины, широкое использование в практической медицине обусловлено их множественными плейотропными эффектами. Результаты проведенных исследований продемонстрировали как их прямое, так и опосредованное положительное влияние на репродуктивную функцию, что делает привлекательным их применение в комплексной стратегии прегравидарной подготовки. Однако, несмотря на высокую эффективность и хорошую переносимость инкретиномиметиков, следует учитывать особенности их фармакокинетики и фармакодинамики, а также неуточненный тератогенный эффект, ограничивающие их применение на преконцептуальном этапе, во время беременности и в период лактации. Таким образом, ключевым принципом назначения данных препаратов является персонализированный и мультидисциплинарный подход, при котором решение вопроса о применении инкретиномиметиков у женщин, планирующих беременность, принимается после взвешенной оценки всех потенциальных преимуществ и рисков.
Сведения об авторах:
Каронова Татьяна Леонидовна — д.м.н., руководитель НИЛ клинической эндокринологии, профессор кафедры эндокринологии с клиникой ИМО ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0002-1547-0123
Никулина Арина Алексеевна — младший научный сотрудник НИЛ клинической эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0001-6066-3525
Мурашева Анна Владимировна — к.м.н., старший научный сотрудник НИЛ клинической эндокринологии, доцент кафедры факультетской терапии с клиникой ИМО ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0003-3300-1280
Тиселько Алена Викторовна — д.м.н., ведущий научный сотрудник ФГБНУ «НИИ акушерства, гинекологии и репродуктологии имени Д.О. Отта»; 199034, Россия, г. Санкт-Петербург, Менделеевская линия, д. 3; ORCID iD 0000-0002-2512-833
Черникова Алена Тимуровна — к.м.н., старший научный сотрудник НИЛ клинической эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0002-4878-6909
Шавинина Анна Игоревна — аспирант кафедры эндокринологии с клиникой ИМО ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2.
Сухоцкая Нина Александровна — менеджер по медицинскому маркетингу ООО «ГЕРОФАРМ»; 123112, Россия, г. Москва, Пресненская наб., д. 6, стр. 2, под. 3.
Контактная информация: Никулина Арина Алексеевна, e-mail: armikhaylova@yandex.ru
Прозрачность финансовой деятельности: исследование выполнено при поддержке Министерства здравоохранения Российской Федерации (соглашение № 124021600064-8).
Конфликт интересов: Н.А. Сухоцкая является сотрудником ООО «ГЕРОФАРМ». Остальные авторы заявляют об отсутствии конфликта интересов.
Статья поступила 12.08.2025.
Поступила после рецензирования 04.09.2025.
Принята в печать 29.09.2025.
About the authors:
Tatyana L. Karonova — Dr. Sc. (Med.), Head of the Research Laboratory of Clinical Endocrinology, Professor of the Department of Endocrinology with Clinic of the Institute of Medical Education, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-1547-0123
Arina A. Nikulina — Junior Researcher, Research Laboratory of Clinical Endocrinology, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0001-6066-3525
Anna V. Murasheva — C. Sc. (Med.), Senior Researcher, Research Laboratory of Clinical Endocrinology, Associate Professor of the Department of Faculty Therapy with Clinic of the Institute of Medical Education, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0003-3300-1280
Alyona V. Tiselko — Dr. Sc. (Med.), Leading Researcher, D.O. Ott Research Institute of Obstetrics, Gynecology, and Reproduction; 3, Mendeleevskaya line, St. Petersburg, 199034, Russian Federation; ORCID iD 0000-0002-2512-833
Alyona T. Chernikova — C. Sc. (Med.), Senior Researcher, Research Laboratory of Clinical Endocrinology, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-4878-6909
Anna I. Shavinina — postgraduate student of the Department of Endocrinology with Clinic of the Institute of Medical Education, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation.
Nina A. Sukhotskaya — Medical Marketing Manager, GEROPHARM LLC; 6, build. 2, entrance 3, Presnenskaya emb., Moscow, 123112, Russian Federation.
Contact information: Arina A. Nikulina, e-mail: armikhaylova@yandex.ru
Financial Disclosure: the study was supported by the Ministry of Health of the Russian Federation (Agreement No. 124021600064-8).
Conflict of interest: N.A. Sukhotskaya is an employee of GEROPHARM LLC. The remaining authors declare no conflict of interest.
Received 12.08.2025.
Revised 04.09.2025.
Accepted 29.09.2025.
1World Obesity Federation. Prevalence of Obesity. 2024. (Electronic resource.) URL: https://www.worldobesity.org/about/about-obesity/prevalence-of-obesity (access date: 21.05.2025).
2World Obesity Federation. World Obesity Atlas. 2025. (Electronic resource.) URL: https://www.worldobesity.org/resources/resource-library/world-obesity-atlas-2025 (access date: 21.05.2025).
3Клинические рекомендации. Ожирение у взрослых. 2024. (Электронный ресурс.) URL: https://rae-org.ru/system/files/documents/pdf/ozhirenie_vzroslye_0.pdf (дата обращения: 21.01.2025).
4Obesity Canada. Canadian Adult Obesity Clinical Practice Guidelines. 2025. (Electronic resource.) URL: https://obesitycanada.ca/healthcare-professionals/adult-clinical-practice-guideline/ (access date: 21.01.2025).
5Medscape. AACE/ADA 2025 Type 2 Diabetes Management Algorithm. 2025. (Electronic resource.) URL: https://emedicine.medscape.com/article/123702-clinical (access date: 21.01.2025).
6European Medicines Agency. Mounjaro (tirzepatide). 2025. (Electronic resource.) URL: https://www.ema.europa.eu/en/medicines/human/EPAR/mounjaro (access date: 21.01.2025).