Введение
У пациентов с сахарным диабетом 2 типа (СД2) и гипертонической болезнью (ГБ) значительно возрастает риск развития серьезных сердечно-сосудистых осложнений, таких как ишемическая болезнь сердца, инсульт, сердечная недостаточность (СН), заболевания периферических артерий и внезапная сердечная смерть. Сочетание СД2 и ГБ оказывает синергическое негативное воздействие на сердечно-сосудистую систему, приводя к дисфункции эндотелия, активации ренин-ангиотензиновой системы (РААС), симпатикотонии, ремоделированию миокарда, ускоренному развитию и прогрессированию диастолической дисфункции (ДД) левого желудочка (ЛЖ) сердца. Категории коморбидных больных требуется тщательный контроль уровня артериального давления (АД), гликемии и достижение их целевых значений. Стратегии лечения у пациентов с ГБ при СД2 включают изменение образа жизни и использование фармакологической терапии, направленной на блокаду РААС. Между тем эти пациенты также могут получить пользу от лечения сахароснижающими препаратами с кардиопротективным эффектом. Одной из наиболее перспективных групп, положительно влияющих на сердечно-сосудистую систему, являются ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2). Данные крупномасштабных клинических исследований неизменно показывают, что эффекты иНГЛТ-2 выходят далеко за рамки гликемического контроля, снижая важные сердечно-сосудистые и почечные риски [1]. В экспериментальных и клинических исследованиях иНГЛТ-2 доказали свою способность уменьшать фиброз миокарда и улучшать диастолическую функцию ЛЖ, которая является одним из начальных признаков изменения функции сердца у больных с СД2 и ГБ. К класс-эффекту иНГЛТ-2 относят снижение АД [2]. Согласно прямому сравнительному исследованию сердечно-сосудистых событий у пациентов с СД2, получавших разные иНГЛТ-2, риск сердечно-сосудистых событий (включая СН, инфаркт миокарда, стенокардию, инсульт и фибрилляцию предсердий (ФП)) сопоставим между различными иНГЛТ-2 [3]. Целенаправленные исследования по влиянию иНГЛТ-2 ипраглифлозина на метаболические показатели, структурно-функциональные характеристики сердца, маркеры фиброза в группе пациентов с СД2 и ГБ без атеросклеротических сердечно-сосудистых заболеваний (АССЗ) не проводились.
Цель исследования: изучить влияние иНГЛТ-2 ипраглифлозина на метаболические показатели и структурно-функциональные характеристики сердца у пациентов с СД2 и ГБ без АССЗ.
Материал и методы
Проведено проспективное когортное исследование в группе пациентов с СД2 и ГБ на базе кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России, БУЗОО «Клинический кардиологический диспансер» в период с 2023 по 2025 г. Исследование одобрено локальным этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России (протокол № 10 от 19.09.2023).
Критерии включения: возраст 18–65 лет; наличие ГБ, СД2, ДД ЛЖ; противодиабетическая и гипотензивная терапии неизменны в течение 12 нед., предшествующих включению в исследование (в том числе суточная доза инсулина не менялась более чем на 10% в сравнении с суточной дозой на момент включения); значения HbA1c выше целевых, но меньше 10,0%; индекс массы тела (ИМТ) <40 кг/м2.
Критерии невключения: СД 1 типа, симптоматическая артериальная гипертензия, HbA1c>10%, фракция выброса (ФВ) ЛЖ <40%, прием препаратов группы иНГЛТ-2, агонистов рецепторов глюкагоноподобного пептида-1, ФП; АССЗ, неатеросклеротические ССЗ (кардиомиопатии, миокардиты) в анамнезе; гемодинамически значимые пороки сердца, анемии различного генеза, сопутствующие заболевания или патологические состояния, не перечисленные выше, которые могут исказить результаты исследования (печеночная недостаточность, почечная недостаточность, остеопороз, злоупотребление алкоголем, употребление наркотиков, терапия системными глюкокортикостероидами, изменение суточной дозы L-тироксина в течение 2 мес. до включения в исследование, медикаментозная терапия ожирения, онкологические заболевания и пр.).
Клинический статус пациентов, включая результаты лабораторных и инструментальных методов обследования, оценивали исходно, через 12 и 24 нед. терапии. Всем пациентам проводили антропометрические измерения (рост, масса тела, окружность талии (ОТ), ИМТ, индекс формы тела, индекс округлости тела (Body Roundness Index, BRI)) [4, 5]. Лабораторное обследование включало биохимический анализ крови, определение уровня предшественника мозгового натрийуретического пептида (NT-proBNP), C-терминального пропептида проколлагена I типа (PICP). Двухмерная эхокардиография выполнялась на аппарате Toshiba Aplio 400 (Япония) с оценкой ФВ ЛЖ по Симпсону, диастолической функции ЛЖ по стандартному протоколу одним оператором [6–8]. Для суточного мониторирования АД использовали регистратор Schiller (Швейцария), с последующим анализом результатов на IBM PC-совместимом компьютере (программа МТ-200 «БиПиЛаб» Н #14060875 Rev.BP2005-01.04.00.2540). Холтеровское мониторирование проводили на портативных кардиорегистраторах (Schiller, Швейцария) по общепринятой методике с анализом вариабельности сердечного ритма. Выявленные аритмии классифицировали следующим образом: наджелудочковая экстрасистолия, желудочковая экстрасистолия, сочетание наджелудочковой и желудочковой экстрасистолии, ФП. Оценивали частоту желудочковой и наджелудочковой экстрасистолии относительно статистической нормы. За статистическую норму принимали экстрасистолию с частотой менее 200 экстрасистол за 24 ч мониторирования [9]. Анализировали следующие показатели: среднюю частоту сердечных сокращений (ЧСС) в течение 1 сут; максимальную ЧСС в течение 1 сут; минимальную ЧСС в течение 1 сут; циркадный индекс; вариабельность интервала R-R (NN, мс), стандартное отклонение интервала R-R (SDNN, мс), стандартное отклонение усредненных нормальных синусовых интервалов R-R всех 5-минутных периодов за все время наблюдения (SDANN, мс), среднеквадратичное отклонение различий между интервалами сцепления соседних интервалов R-R (rMSSD, мс), долю последовательных интервалов R-R, различающихся более чем на 50 мс (pNN50, %). Для оценки функционального статуса и выносливости пациентов проводили тест 6-минутной ходьбы (ТШХ) [10]. Качество жизни оценивали с помощью Миннесотского опросника [11]. Для оценки общих поведенческих аспектов отношения больных к приему лекарств использовали шкалу Мориски — Грина 8 [12, 13], для комплексной оценки приверженности терапии — опросник КОП-25 [14].
Статистический анализ проводили с использованием программных пакетов анализа Microsoft Excel, Statistica 6,0 (StatSoft Inc., США). Количественные данные представлены как медиана (Me), нижний квартиль (Q1) и верхний квартиль (Q3). При сравнении выборок по количественным и качественным признакам в двух зависимых группах использовали критерии Вилкоксона, Манна — Уитни, и χ2 Мак-Немара с поправкой Йейтса соответственно. Уровень значимости — 0,05.
Результаты исследования
В соответствии с критериями включения/невключения в исследовании приняли участие 30 пациентов (возраст 54,0 [50,0; 60,0] года, мужчин — 14), которым был назначен ипраглифлозин в дозе 50 мг 1 р/сут в монотерапии или в комбинации с другими сахароснижающими препаратами. Терапия СД2 изначально была представлена в виде монотерапии: метформин (МЕТ) — 46,67% (n=14), производные сульфонилмочевины (ПСМ) — 3,33% (n=1); 2-компонентной терапии: МЕТ + ПСМ — 13,33% (n=4), МЕТ + ингибиторы дипептидилпептидазы-4 (иДПП-4) — 3,33% (n=1), МЕТ + инсулин длительного действия (ИДД) — 6,67% (n=2); 3-компонентной терапии: МЕТ + иДПП-4 + ИДД — 3,33% (n=1); диетотерапии — 23,33% (n=7).
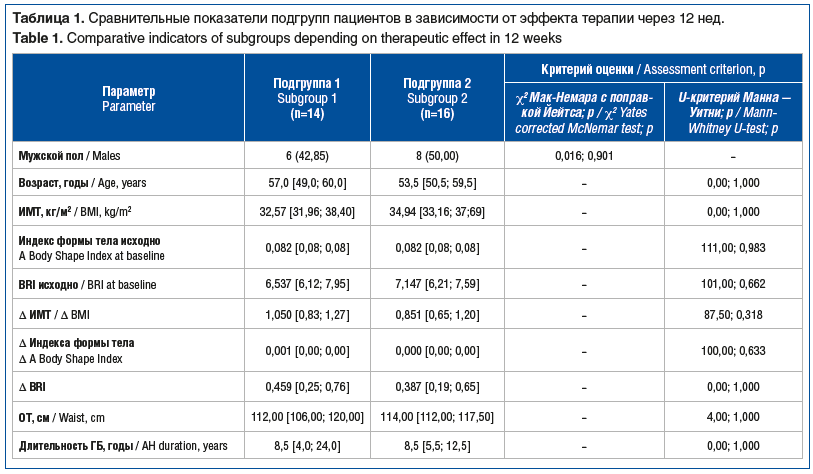
Через 12 нед. наблюдения критерии ДД ЛЖ не выполнялись у 14 пациентов (χ2 Мак-Немара 13,018, р<0,001). При проведении клинических сопоставлений между подгруппой 1 (n=14, положительная динамика с устранением ДД ЛЖ) и подгруппой 2 (n=16, отсутствие динамики по ДД ЛЖ) установлено, что исходно в подгруппе 2 чаще регистрировали более высокие значения АД, нефропатию (хроническая болезнь почек (ХБП) С1–2), периферическую полинейропатию, пациенты значимо чаще получали 3-компонентную сахароснижающую терапию (табл. 1).



К 24-й неделе терапии ипраглифлозином у всех (n=30) пациентов отмечена статистически значимая положительная динамика субъективного статуса: уменьшилось количество жалоб общего характера (р<0,001), жалоб на одышку при физической нагрузке (р<0,001), шум в ушах (р=0,003), мелькание «мушек» перед глазами (р=0,025), отеки нижних конечностей (р=0,003), снижение памяти (р=0,003), сердцебиение (р<0,001), сниженное настроение (р=0,009), беспричинную тревогу, беспокойство (р=0,015) (см. рисунок).

По результатам ТШХ, проведенного исходно и через 24 нед., отмечена положительная динамика (с 479,0 [430,0; 510,0] до 489,50 [455,00; 540,00] м соответственно; Т=13,00; р<0,001). Субъективная переносимость физической нагрузки по шкале Борга значимо улучшилась (3,0 [3,0; 4,0] и 2,0 [2,0; 3,0] соответственно; Т=0,00, р<0,001).
При сравнении исходных показателей и через 24 нед. терапии ипраглифлозином у пациентов отмечено статистически значимое снижение массы тела (100,00 [93,00; 111,00] и 96,50 [89,00; 108,00] кг соответственно; Т=0,00; р<0,001), ИМТ (34,44 [32,01; 37,81] и 33,11 [31,22; 36,81] кг/м2 соответственно; Т=0,00; р<0,001), ОТ (113,00 [108,00; 119,00] и 109,0 [104,00; 115,00] см соответственно; Т=0,00; р<0,001). Общепризнано, что содержание жира в организме нельзя оценить по ИМТ [15]. В 2013 г. был предложен новый антропометрический показатель — индекс округлости тела (BRI), разработанный на основе эллиптических моделей формы тела человека и эксцентриситета для оценки процентного содержания висцерального и общего жира в организме [16]. BRI, кроме роста и массы тела, дополнительно учитывает ОТ и, следовательно, может более полно отражать распределение висцерального жира. Установлено, что BRI превосходит другие антропометрические показатели в оценке риска развития различных клинических состояний, включая кардиометаболические заболевания. Проспективные исследования показали, что высокий показатель BRI связан со значительным увеличением риска смертности от всех причин и смертности от ССЗ [17–20]. Через 24 нед. терапии ипраглифлозином у пациентов отмечено значимое снижение индекса формы тела (0,082 [0,078; 0,084] и 0,080 [0,077; 0,083] соответственно; Т=50,00, р<0,001) и BRI (7,024 [6,16; 8,01] и 6,23 [5,59; 6,92] соответственно; Т=0,00; р<0,001).
Лечение ипраглифлозином закономерно привело к значимому снижению уровня глюкозы натощак, HbA1c, АЛТ (табл. 2). При этом исходно повышенный уровень АЛТ был отмечен у 11 пациентов, через 24 нед. терапии повышение АЛТ было отмечено у 5 пациентов (χ2 Мак-Немара с поправкой Йейтса 6,036; р=0,015). Выраженная положительная динамика уровня АЛТ согласуется с ранее опубликованными данными, указывающими на потенциал ипраглифлозина как гепатотропного препарата, т. е. перспективного средства для лечения СД2 с повышенным уровнем ферментов печени [21]. Следует отметить обнаруженную тенденцию к снижению уровня ТГ, не достигшую, однако, статистической значимости. Эта динамика обращает на себя внимание в связи с недавно опубликованными результатами комплексного байесовского сетевого метаанализа, продемонстрировавшего, что ипраглифлозин значимо снижал уровень ТГ и был наиболее эффективен по сравнению с эмпаглифлозином и дапаглифлозином [22].
![Таблица 2. Динамика лабораторных показателей на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 2. Laboratory parameter changes associated with 24-week ipragliflozin therapy, Me [Q1; Q3] Таблица 2. Динамика лабораторных показателей на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 2. Laboratory parameter changes associated with 24-week ipragliflozin therapy, Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/d52/l343h2jkes5b1o6p9k9abjh0htaynlan/710-5.png)
Оценка влияния ипраглифлозина на краткосрочную вариабельность артериального давления (ВАД) продемонстрировала значимое снижение среднего САД и ДАД как в дневное, так и в ночное время (р<0,05) (табл. 3).
![Таблица 3. Динамика показателей суточного мониторирования АД на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 3. Changes in daily blood pressure monitoring data associated with 24-week ipragliflozin therapy, Me [Q1; Q3] Таблица 3. Динамика показателей суточного мониторирования АД на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 3. Changes in daily blood pressure monitoring data associated with 24-week ipragliflozin therapy, Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/842/1kg47j497v6qdt655myq2sphn761a44h/710-6.png)
По результатам холтеровского мониторирования исходно у всех пациентов диагностированы эпизоды синусовой тахикардии и суправентрикулярных экстрасистол. Желудочковые экстрасистолы I класса (одиночные мономорфные экстрасистолы, I класс по Лауну — Вольфу) отмечались у большинства (28/30) пациентов. Через 24 нед. приема ипраглифлозина отмечалось значимое снижение количества эпизодов суправентрикулярных и желудочковых экстрасистол (р<0,05) (табл. 4). Не установлено значимой динамики по таким показателям, как средняя ЧСС в течение дня (79,00 [73,00; 86,00] и 79,00 [76,00; 86,00] в 1 мин соответственно; Т=174,00; р=0,969), средняя ЧСС ночью (65,50 [62,00; 72,00] и 67,00 [62,00; 76,00] в 1 мин соответственно; Т=142,00; р=0,394).
![Таблица 4. Динамика показателей холтеровского монито- рирования на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 4. Changes in Holter monitoring data associated with 24-week ipragliflozin therapy, Me [Q1; Q3] Таблица 4. Динамика показателей холтеровского монито- рирования на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 4. Changes in Holter monitoring data associated with 24-week ipragliflozin therapy, Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/4aa/jzdcwnugivf1lxquqqj7vvtwpwrho08c/710-7.png)
При оценке показателей вариабельности сердечного ритма в динамике после 24 нед. лечения было отмечено значимое снижение показателя рNN50 (р=0,005) в пределах возрастных референсных значений (табл. 5).
![Таблица 5. Динамика временных показателей вариабель- ности сердечного ритма на фоне терапии ипраглифлози- ном в течение 24 нед., Me [Q1; Q3] Table 5. Changes in temporal parameters of heart rate variability associated with 24-week ipragliflozin therapy, M Таблица 5. Динамика временных показателей вариабель- ности сердечного ритма на фоне терапии ипраглифлози- ном в течение 24 нед., Me [Q1; Q3] Table 5. Changes in temporal parameters of heart rate variability associated with 24-week ipragliflozin therapy, M](https://www.rmj.ru/upload/medialibrary/649/aiizxpfkcti3jckj8ovnuook9jxfzuu0/710-8.png)
По данным ЭхоКГ было отмечено увеличение Е/А и Е, что может говорить о положительном воздействии ипраглифлозина на процесс ремоделирования ЛЖ (табл. 6). Критериям ДД ЛЖ не удовлетворяли 18/30 пациентов (χ2=0,603, р=0,438).
![Таблица 6. Динамика эхокардиографических показателей на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 6. Echocardiographic parameter changes associated with 24-week ipragliflozin therapy, Me [Q1; Q3] Таблица 6. Динамика эхокардиографических показателей на фоне терапии ипраглифлозином в течение 24 нед., Me [Q1; Q3] Table 6. Echocardiographic parameter changes associated with 24-week ipragliflozin therapy, Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/643/qwplb0630ol8bcjqito5ngblwf5dyc1y/710-9.png)
Клинические сопоставления, проведенные через 24 нед. лечения, между подгруппой пациентов с устранением ДД ЛЖ (n=18, подгруппа 1) и подгруппой пациентов без значимой динамики показателей диастолической функции (n=12, подгруппа 2), выявили различия между подгруппами (табл. 7): в частности, в подгруппе 2 чаще регистрировалась диабетическая полинейропатия, ХБП С1–2, пациенты реже имели 1-ю степень повышения АД, меньше пациентов достигли целевого АД в течение наблюдения (см. табл. 7). Последнее косвенно подтверждает известные данные о значимом вкладе гипертензивных расстройств в формирование ДД ЛЖ у пациентов с СД2 и ГБ.

Зарегистрированные положительные функциональные изменения сопровождались статистически значимой динамикой уровня NT-proBNP (см. табл. 2), что можно трактовать как положительные изменения нейрогуморальной активации сердца. Известно, что одним из значимых циркулирующих маркеров фиброза является PICP, отражающий образование коллагена I типа. Согласно имеющимся данным уровень PICP коррелирует с наличием ДД ЛЖ у пациентов с СД2 [23–25]. В нашем исследовании не отмечено значимого изменения исходного уровня биомаркера PICP (см. табл. 2) через 24 нед. терапии, что может быть связано с ограничениями нашего исследования (небольшой объем выборки), выборкой пациентов без АССЗ.
Критериями оценки переносимости ипраглифлозина служили субъективные ощущения больных на фоне терапии на каждом визите. За время наблюдения отмечалась хорошая переносимость препарата, отсутствовали побочные эффекты. Отмечено повышение приверженности терапии по шкале Мориски — Грина 8 (исходно — 6,0 [5,0; 7,0] балла, через 24 нед. — 7,0 [6,0; 8,0] балла (Т=44,00; р=0,040)). По Миннесотскому опроснику качества жизни пациентов суммарный индекс после проведения терапии статистически значимо снизился в общей группе с 9,50 [3,50; 35,0] до 4,32 [3,45; 4,83] соответственно (Т=32,00; р<0,001), что свидетельствует о повышении качества жизни по самооценке пациента. При анализе приверженности терапии на основании данных опросника КОП-25 была выявлена положительная динамика в показателе важности модификации образа жизни (Т=34,00; р<0,001).
Заключение
При изучении влияния ипраглифлозина на метаболические показатели, структурно-функциональные характеристики сердца у пациентов с СД2 и ГБ с ДД ЛЖ в краткосрочном проспективном наблюдении в течение 24 нед. была отмечена значимая положительная динамика субъективного клинического статуса, антропометрических параметров (масса тела, ИМТ, ОТ, индекс формы тела, BRI), показателей углеводного обмена и функции печени (АЛТ, глюкоза, HbA1c), уровня биомаркера ремоделирования ЛЖ (NT-proBNP), функциональных показателей деятельности сердца (увеличение Е/А и Е, устранение эхокардиографических признаков ДД ЛЖ (60% пациентов), снижение количества эпизодов суправентрикулярных и желудочковых экстрасистол, улучшение характеристик краткосрочной вариабельности АД). Применение ипра-глифлозина в краткосрочном периоде наблюдения не было связано со значимым изменением содержания биомаркера фиброза (PICP). Прием ипраглифлозина характеризовался хорошей переносимостью при удовлетворительной приверженности пациентов. В подгруппе пациентов с отсутствием динамики через 12 нед. по ДД ЛЖ чаще регистрировались более высокая степень АГ, нефропатия (ХБП С1–2), периферическая полинейропатия, пациенты значимо чаще получали 3-компонентную сахароснижающую терапию; в подгруппе с отсутствием динамики через 24 нед. по ДД ЛЖ пациенты реже имели целевой уровень АД к моменту завершения наблюдения, у них также чаще регистрировали нефропатию (ХБП С1–2), периферическую полинейропатию. Указанные признаки могут рассматриваться как маркеры меньшей вероятности ответа на терапию иНГЛТ2 ипраглифлозином в виде устранения признаков ДД ЛЖ сердца через 12 и 24 нед. наблюдения. Устранение ДД ЛЖ, фактора риска развития СН, у 60% пациентов в ходе нашего краткосрочного наблюдения может свидетельствовать о положительном эффекте ипраглифлозина, реализованном на ранних стадиях сердечно-сосудистого континуума, и способном потенциально улучшить долгосрочный прогноз пациентов с СД2 и ГБ. В группе пациентов с СД2, ГБ и ДД ЛЖ сердца без АССЗ впервые в краткосрочном наблюдении продемонстрированы клинически значимые метаболические и кардиопротективные эффекты иНГЛТ2 ипраглифлозина, что может служить обоснованием преимуществ его применения в указанной группе пациентов.
Сведения об авторах:
Друк Инна Викторовна — д.м.н., доцент, заведующая кафедрой внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-8317-7765
Сафронова Светлана Сергеевна — ассистент кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-5852-2782
Канунникова Олеся Игорьевна — к.м.н., доцент кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0009-0003-3721-4379
Быкова Елена Андреевна — врач-эндокринолог БУЗОО «КДЦ»; 644024, Россия, г. Омск, ул. Ильинская, д. 9.
Ушакова Татьяна Александровна — врач-терапевт БУЗОО «ГБ № 7»; 644027, Россия, г. Омск, ул. Лизы Чайкиной, д. 21.
Новицкая Марина Васильевна — врач-эндокринолог БУЗОО «ГП № 3»; Россия, 644060, г. Омск, ул. Вильямса, д. 26а.
Контактная информация: Друк Инна Викторовна, e-mail: drukinna@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 14.08.2025.
Поступила после рецензирования 08.09.2025.
Принята в печать 30.09.2023.
About the authors:
Inna V. Druk — Dr. Sc. (Med.), Associate Professor, Head of the Department of Internal Diseases and Family Medicine of the Additional Professional Education; Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-8317-7765
Svetlana S. Safronova — Teaching Assistant of the Department of Internal Diseases and Family Medicine of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-5852-2782
Olesya I. Kanunnikova — C. Sc. (Med.), Assistant Professor of the Department of Internal Diseases and Family Medicine of Continuing Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0009-0003-3721-4379
Elena A. Bykova — Endocrinologist, Clinical Diagnostic Center; 9, Ilyinskaya str., Omsk, 644024, Russian Federation.
Tatyana A. Ushakova — Internist. City Hospital No. 7; 21, Liza Chaikina str., Omsk, 644027, Russian Federation.
Marina V. Novitskaya — Endocrinologist, City Polyclinic No. 3; 26a, Williams str., Omsk, 644060, Russian Federation.
Contact information: Inna V. Druk, e-mail: drukinna@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 14.08.2025.
Revised 08.09.2025.
Accepted 30.09.2025.