Введение
Аллоиммунизация (изоиммунизация) определяется как иммунный ответ на чужеродные антигены представителей одного и того же вида. Фетоматеринская изоиммунизация предполагает взаимодействие иммунной системы матери и плода, являющегося материнским аллотрансплантатом [1]. Пассивная передача гуморального иммунитета посредством трансплацентарного переноса материнских IgG обычно является защитным механизмом, развивающимся после 16-й недели беременности [2]. Если в организм женщины во время беременности попадает антиген плода, который организм матери не распознает как «свой», развивается изоиммунизация. Это воздействие приводит к сенсибилизации и выработке антител против антигена плода [3]. Фетоматеринская аллоиммунизация в большинстве случаев связана с гематологическими заболеваниями, такими как гемолитическая болезнь по резус-фактору, ABO, а также по редким факторам, аллоиммунные тромбоцитопения и нейтропения [4].
Фетоматеринская изоиммунизация
Кроме гематологических заболеваний, в настоящее время известно, что фетоматеринская аллоиммунизация также приводит к заболеваниям с поражением отдельных органов. Самым изученным таким заболеванием является антенатальный мембранозный гломерулонефрит (АМГ), или мембранозная нефропатия. Основным генетическим дефектом, при котором развивается эта болезнь, является мутация в гене MME (ген, отвечающий за продукцию нейтральной эндопептидазы (НЭП)), у гомозиготных матерей НЭП не вырабатывается. Когда плод и плацента содержат нормальную копию гена MMEи, следовательно, нормальное содержание НЭП, может произойти аллоиммунизация матери с последующей продукцией анти-НЭП-антител класса G. Эти антитела против НЭП передаются плоду через плаценту, в результате чего происходит отложение внутриклубочкового иммунного комплекса и повреждение почек [4–6].
При упомянутых выше фетоматеринских изосенсибилизациях IgG-антитела матери вырабатываются против антигенов плода, унаследованных от отца. Но есть уникальная фетоматеринская изоиммунизация против гепатоцитов печени плода, которая не зависит от наследственности отца. При рождении ребенка с гестационным аллоиммунным поражением печени (ГАПП), мать может иметь в анамнезе несколько беременностей, закончившихся рождением здоровых детей, но после рождения ребенка с ГАПП вероятность рождения в последующем больных детей составляет около 90%. Девочки после перенесенного ГАПП могут иметь впоследствии здоровых детей [1]. Таким образом, печень может стать мишенью для иммуноопосредованной атаки, при которой внутриутробная передача материнских антител вызывает повреждение печени плода [1, 3].
Механизм развития ГАПП
Механизм развития ГАПП достаточно хорошо изучен. При фетоматеринской аллоиммунизации происходит повреждение непосредственно гепатоцитов плода. После 16–18 нед. беременности материнские IgG могут попасть в кровоток плода через плаценту. Как только антитела поступают в систему кровообращения плода, происходит связывание антигена плода с печеночным антителом матери, что вызывает активацию комплемента и формирует комплекс, поражающий мембрану гепатоцита [7]. В последующем происходит комплемент-индуцированное разрушение гепатоцитов, в результате их массивного некроза может остаться до 10–25% массы печени от нормы. В некоторых гистологических образцах печени гепатоциты не определяются совсем [8]. Характерен выраженный паренхиматозный фиброз, обычно наблюдаются регенеративные узелки. Цирроз печени диагностируется у 50% младенцев с ГАПП [9].
Специфический антиген печени плода, который запускает процесс сенсибилизации матери, до сих пор не выделен. Антиген-мишень, по-видимому, представляет собой специфический для гепатоцитов белок, который либо уникально экспрессируется гепатоцитами плода, либо секвестрируется в зрелой печени. Клетки печени, не являющиеся гепатоцитами, и внепеченочная ткань не подвергаются атаке этого первичного иммунного комплекса. K. Rieneck et al. [10] выдвинули гипотезу, что антиген экспрессируется исключительно во время внутриутробной жизни при всех беременностях.
Как уже было отмечено выше, опосредованное комплементом повреждение гепатоцитов является определяющим признаком ГАПП [11]. Для подтверждения аллоиммунного повреждения печени плода было предложено использовать иммуногистохимическое исследование ткани печени плода с целью обнаружения комплекса С5b-9 в гепатоцитах, который образуется при активации комплемента [1, 3, 9, 11]. Более поздние исследования показали, что положительное иммуноокрашивание C5b-9 в гепатоцитах не специфично для ГАПП, поскольку оно может присутствовать и в случаях, не связанных с ГАПП. Таким образом, диагноз ГАПП может быть поставлен на основании совокупности клинических, биохимических, рентгенологических и гистологических данных [12].
Неонатальный гемохроматоз как проявление ГАПП
История открытия ГАПП была тесно связана с исследованием неонатального гемохроматоза (НГ). НГ был впервые описан в середине ХХ в. как наследственное нарушение обмена железа, характеризующееся увеличением всасывания железа в кишке и отложением его в клетках печени и других органах [1]. У младенцев с НГ часто обнаруживался цирроз, что наталкивало на мысль о внутриутробном поражении печени. Для этого заболевания использовались такие синонимы, как «неонатальная болезнь накопления железа» и «перинатальный гемохроматоз», подчеркивая роль перегрузки железом в патогенезе данного заболевания [9].
Однако до недавнего времени причина такого повреждения оставалась неизвестной. Поскольку прослеживалась семейная закономерность заболевания (у братьев и сестер), подозревался генетический дефект, но тщательно проведенное исследование не выявило локуса гена гемохроматоза у этих детей [13]. Кроме того, модель рецидива не поддавалась генетическому объяснению, поскольку заболевание передается только по материнской линии с очень высокой вероятностью (до 90%) рождения впоследствии больного ребенка [9].
Благодаря исследованиям, выполненным в начале ХХI в., полностью изменились представления об этиологии, патогенезе, менеджменте и прогнозе НГ. Если ранее существовало представление, что первичным звеном патогенеза НГ является перегрузка железом печени и других органов, как при наследственном гемохроматозе, то позже было показано, что аллоиммунное поражение печени предшествует избыточному накоплению железа и предопределяет его [1].
Механизмы перегрузки железом при НГ были изучены. Печень плода контролирует транспорт железа через плаценту аналогично тому, как постнатальная печень регулирует всасывание железа в кишечнике. При недостатке железа печень плода вырабатывает гепсидин (25-аминокислотный протеин, продуцирующийся исключительно фетальной печенью), который регулирует доставку железа в печень [8]. При ГАПП содержание гепсидина значительно уменьшено вследствие массовой гибели гепатоцитов, что делает невозможным контроль за поступлением железа, в результате чего образуется его перегрузка и отложение избыточного железа в органах и тканях. Внепеченочные ткани, пораженные сидерозом, не имеют признаков повреждения, в отличие от наследственного гемосидероза, так как при ГАПП происходит повреждение только гепатоцитов [1].
Другими причинами развития НГ могут быть перинатальные инфекции (парвовирус В19 или цитомегаловирус), трисомия 21, митохондриальные болезни (в том числе мутация гена DGUOK), дефект синтеза желчных кислот (мутации гена SRD5B1), врожденные нарушения метаболизма железа, миофиброматоз, различные синдромы (синдром GRACILE, синдром Мартинес — Фриаса, трихогепатоэнтеральный синдром). Предполагается, что в этих случаях причиной НГ является повреждение печени плода, приводящее к нарушению регуляции потока железа через плаценту. Эти заболевания составляют около 2% от всех случаев НГ [9].
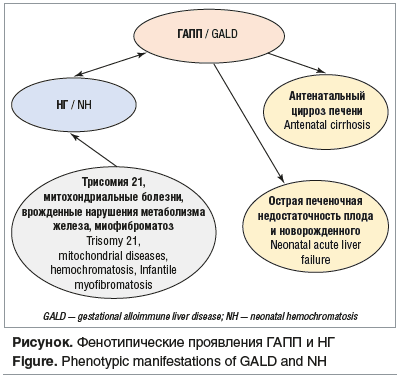
Таким образом, ГАПП в большинстве случаев является причиной НГ, а НГ является симптомом ГАПП [14]. Но НГ не является эксклюзивным фенотипом, могут быть диагностированы другие состояния и заболевания, развившиеся вследствие аллоиммунного поражения печени плода [9] (см. рисунок).

Фенотипические проявления ГАПП в настоящее время включают:
-
НГ, протекающий с острой неонатальной недостаточностью печени и печеночным и внепеченочным сидерозом;
-
острую печеночную недостаточность плода без перегрузки железом;
-
цирроз печени, развившийся в антенатальном периоде [15].
Критерием постановки диагноза НГ является обнаружение скопления железа во внепеченочных тканях. Обнаружение железа в печени не является диагностически значимым, поскольку нормальная печень новорожденного может содержать определенное количество окрашиваемого железа. Кроме того, патологический сидероз печени можно наблюдать у новорожденных при некоторых заболеваниях печени [9]. Внепеченочный сидероз у младенцев диагностируется при окрашивании железа (берлинская лазурь, окраска Перла) в биоптатах тканей, пораженных сидерозом, или с помощью магнитно-резонансной томографии (МРТ). Железистую ткань, содержащую железо, проще всего получить при биопсии слизистой оболочки полости рта [16]. Эта минимально инвазивная операция обычно хорошо переносится, имеет крайне редкие осложнения в виде местного кровотечения, не требует предварительного переливания свежезамороженной плазмы. МРТ (Т2-режим) также может использоваться для диагностики сидероза, поскольку железосодержащая ткань имеет другую магнитную восприимчивость, отличную от той, которую проявляет нормальная ткань. При МРТ-исследовании может быть выявлен внепеченочный сидероз поджелудочной железы, щитовидной железы и слюнных желез. Другие органы, которые могут быть поражены, это паращитовидные железы, тимус, почечные канальцы, аденогипофиз и т. п. В селезенке, лимфатических узлах и костном мозге обычно не выявляются отложения железа при НГ, так как ретикулоэндотелиальная система не вовлекается в процесс. Чувствительность одного теста составляет 60%, при использовании двух методов — около 80% [16].
Клинические проявления ГАПП
Клиническая картина ГАПП неспецифична и может иметь полиморфизм симптоматики [17]. Для диагностики ГАПП нужно не только знать об этом заболевании, но и иметь представления о широком спектре его проявлений: от острой печеночной недостаточности до субклинического поражения печени. В том числе близнецы могут иметь разные клинические проявления повреждения печени; один из близнецов может пострадать значительно серьезнее, а другой — в минимальной степени [18].
Для ГАПП характерно рождение детей недоношенными и/или с задержкой внутриутробного развития. Наиболее частым осложнением беременности при ГАПП является маловодие. Антенатальные признаки, выявленные при проведении ультразвукового обследования беременных, такие как водянка плода, фетальная гепатомегалия и асцит, встречаются реже [1].
Известно, что ГАПП может манифестировать как внутриутробно с 18 нед. беременности, так и после рождения до 3 мес. жизни, но в большинстве случаев печеночная недостаточность диагностируется в течение нескольких часов после рождения [9]. Признаки ГАПП неспецифичны, отмечается гипогликемия, значимая коагулопатия, которая может проявляться кровотечениями различной локализации (внутричерепные, кишечные, легочные, из пупочной ранки и др.), отеки с наличием асцита или без вследствие гипоальбуминемии, олигоурия. У ребенка диагностируются признаки не только острой печеночной недостаточности, но и полиорганной недостаточности. Часто больному малышу ставится диагноз генерализованного сепсиса без подтверждения бактериемии. Желтуха развивается в первые дни после рождения [1, 9]. Эти клинические проявления связаны с нарушением белково-синтетической функции печени (гипопротеинемия и снижение плазменных факторов коагуляции).
Лабораторные проявления ГАПП
При лабораторном обследовании выявляются типичные признаки печеночной недостаточности, проявляющейся в первую очередь у новорожденных тяжелой коагулопатией, в отличие от острой печеночной недостаточности детей более старшего возраста и взрослых, где на первый план выходят симптомы печеночной энцефалопатии. Неонатальная острая печеночная недостаточность (НОПчН)определяется как нарушение коагуляции, при которой международное нормализованное отношение (МНО) ≥3, так как МНО до 2 может наблюдаться у доношенных новорожденных, а МНО ≥2 — у недоношенных детей после парентерального введения витамина К. Среднее значение МНО при ГАПП превышает 4 (при норме для новорожденных 0,8–1,5), отмечается гипераммониемия, гипогликемия, гипоальбуминемия. Повышение активности аминотрансфераз незначительно и не отражает степень поражения печени (значения активности аланинаминотрансферазы и аспартатаминотрансферазы редко превышают 100 ЕД/л).
Характерно повышение уровня α-фетопротеина (более 100 000 нг/мл, среднее значение 300 000 нг/мл); при нормальных показателях у новорожденных <80 нг/мл. Желтуха редко выявляется при рождении, но уже в первые дни после рождения могут отмечаться повышенные уровни как конъюгированного, так и неконъюгированного билирубина, при этом показания общего сывороточного билирубина могут достигать 500 мкмоль/л и более. Дополнительно может определяться перегрузка железом, включая повышенный уровень ферритина (800–10 000 нг/мл) (при нормальных значениях 40–775 нг/мл) и повышенное насыщение железом (до 95%–100%) доступного трансферрина. Тромбоцитопения тяжелой степени (тромбоциты <50×109/л) отмечается в 10–15% случаев ГАПП вследствие потребления тромбоцитов в местах экстравазации крови [11].
Дифференциальный диагноз
Известно, что ГАПП является самой частой причиной НОПчН (60–90% случаев), на втором месте по частоте встречаемости (20–30%) находятся вирусные инфекции (вирус простого герпеса, вирус герпеса 6-го типа, цитомегаловирус, энтеровирус), остальные заболевания, которые вызывают развитие НОПчН, встречаются значительно реже (лимфогистиоцитоз (до 10%), метаболические (до 1%) и митохондриальные (до 5%) нарушения) [14]. Дифференциальный диагноз ГАПП с другими заболеваниями, протекающими с явлениями острой печеночной недостаточности у новорожденных, представлен в таблице.

Таким образом, при выявлении острой печеночной недостаточности у новорожденного необходимо подозревать ГАПП при сочетании осложненного акушерского анамнеза (перинатальные потери при предыдущих беременностях, маловодие, внутриутробная задержка развития плода), ранней манифестации клинических проявлений (тяжелая коагулопатия, отечный синдром, асцит при отсутствии выраженной гепатомегалии), лабораторных данных (гипогликемия, повышение уровня ферритина и α-протеина) с нарастанием в динамике явлений холестаза [19].
Принципы лечения ГАПП
За последние два десятилетия подход к терапии изменился в связи с открытием аллоиммунного характера заболевания. Внутривенное введение иммуноглобулина (ВВИГ) и заменное переливание крови (ЗПК) пришли на смену традиционной терапии с использованием хелаторов железа и антиоксидантов, как при наследственном гемохроматозе [1, 2]. Целью введения иммуноглобулинов является блокировка материнских антител и препятствие активации комплемента, что способствует регулированию апоптоза [2, 20]. ЗПК проводится для удаления реактивных антител матери. Использование двойных объемов крови при ЗПК и ВВИГ (1 г/кг) повысило уровень выживаемости детей с ГАПП без трансплантации печени до 75% [21]. Стандартного режима лечения ГАПП до сих пор не разработано. В литературе сообщается об использовании от одной до пяти доз введения иммуноглобулинов в течение 2 нед., в зависимости от тяжести состояния, динамики улучшения клинических и лабораторных показателей [9, 21–24]. Показаний к проведению ЗПК и повторных операций также не разработано. По данным P.-J. Yeh et al. [25], 25% детям с НГ проводились повторные ЗПК, у одного ребенка было выполнено 33 операции ЗПК. Для восстановления поврежденной печени, значительное количество гепатоцитов которой погибло, необходимо длительное время, не менее 4–6 нед. [21]. Если ребенок переживет эту неонатальную катастрофу, то печень, способная к регенерации, может полностью восстановить свою функцию к 2–4 годам.
Описан уникальный случай, когда у двух близнецов с НГ была проведена биопсия печени в периоде новорожденности и в возрасте 2–4 лет. Начальная биопсия демонстрировала гистологические изменения, типичные для тяжелого НГ с развитием цирроза печени. Повторная биопсия показала нормальную гистологическую картину печени без патологических данных. Это очень ограниченный опыт, но предполагается, что неонатальная печень, пораженная НГ, достаточно пластична и имеет возможность восстановиться даже после тяжелой травмы [17].
Заключение
Таким образом, ГАПП — это уникальная фетоматеринская изоиммунизация против гепатоцитов печени плода, не зависящая от наследственности отца, самая частая причина НОПчН. ГАПП следует заподозрить у младенца, у которого поражение печени развилось антенатально или сразу после рождения, а также в случаях необъяснимого мертворождения, ранней неонатальной смерти. Наиболее частым фенотипическим проявлением ГАПП является НГ, который мы можем диагностировать на основании обнаружения внепеченочного сидероза с помощью биопсии или МРТ.
В то же время ГАПП может протекать с поражением печени, при котором не обнаруживается отложение железа в печени и других органах, в том числе острая печеночная недостаточность у плода и новорожденного, приводящая к мертворождению или смерти новорожденного. В печени таких младенцев наблюдается массовый некроз гепатоцитов без фиброза или воспаления, что указывает на острейший процесс. Остается неясным, почему у одних детей развивается острая печеночная недостаточность, а у других — врожденный цирроз. Вероятно, все зависит от времени манифестации аллоиммунизации. Если она происходит с 16–18 нед. беременности, то успевает развиться цирроз печени, а если перед родами, когда начинается массивное поступление IgG плоду (после 35 нед.) — острая печеночная недостаточность. В связи с трудностью диагностики и неспецифичностью клинических проявлений отмечается гиподиагностика ГАПП. Необходимо информирование неонатологов и врачей других специальностей (акушеров-гинекологов, гастроэнтерологов, гепатологов, гематологов) не только об аллоиммунной этиологии этого заболевания, о разнообразных его проявлениях, но и для проведения своевременного лечения иммуноглобулинами, выполнения операции ЗПК и профилактического лечения беременных, сенсибилизированных к фетальным антигенам гепатоцитов плода.
СВЕДЕНИЯ ОБ АВТОРАХ:
Бем Елена Венедиктовна — к.м.н., доцент кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0009-0008-9337-5667
Чумакова Галина Николаевна –— д.м.н., профессор кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD0000-0001-5353- 4610
Панченко Александра Сергеевна — д.м.н., профессор кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-2313-3941
Мызникова Ирина Владимировна — заведующая отделением патологии новорожденных и детей раннего возраста Перинатального центра, ассистент кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-8624-1854
Третьякова Кристина Дмитриевна — врач анестезиолог-реаниматолог Перинатального центра ФГБОУ ВО СПбГПМУ Минздрава России;194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0009-0000-6903-3378
Федорова Лариса Арзумановна — к.м.н., доцент кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-9747-762Х
Павлова Светлана Евгеньевна — ассистент кафедры неонатологии с курсами неврологии и акушерства-гинекологии факультета послевузовского и дополнительного профессионального образования ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-5423-0950
Контактная информация: Бем Елена Венедиктовна, e-mail: e.bohm@inbox.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.03.2025.
Поступила после рецензирования 07.04.2025.
Принята в печать 30.04.2025.
ABOUT THE AUTHORS:
Elena V. Bem — C. Sc. (Med.), Assistant Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0009-0008-9337-5667
Galina N. Chumakova — Dr. Sc. (Med.), Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5353-4610
Alexandra S. Panchenko — Dr. Sc. (Med.), Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0003-2313-3941
Irina V. Myznikova — Head of the Department of Pathology of Newborns and Infants of the Perinatal Center, Assistant of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0002-8624-1854
Kristina D. Tretyakova — anesthesiologist and intensive care physician of the Perinatal Center St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0009-0000-6903-3378
Larisa A. Fedorova — C. Sc. (Med.), Assistant Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, St. Petersburg State Pediatric Medical University; Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-9747-762X
Svetlana E. Pavlova — Assistant Professor of the Department of Neonatology with Faculty of Neurology and Obstetrics-Gynecology, Faculty of Postgraduate and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0001-5423-0950
Contact information: Elena V. Bem, e-mail: e.bohm@inbox.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 13.03.2025.
Revised 07.04.2025.
Accepted 30.04.2025.