Введение
Сахарный диабет (СД) представляет собой неинфекционное социально значимое заболевание, которое приводит к инвалидизации и преждевременной смертности во всем мире из-за тяжести диабетических осложнений, существенно сокращает продолжительность жизни. По данным Международной диабетической федерации (International Diabetes Federation, IDF), количество пациентов с СД в возрасте 20–79 лет в мире составит 589 млн, к 2050 г. ожидается увеличение на 45% [1]. Среди пациентов с СД 2 типа (СД2) из-за гетерогенности заболевания различают 5 кластеров: кластер 1 — аутоиммунный диабет, кластер 2 — тяжелый диабет с дефицитом инсулина, кластер 3 — тяжелый инсулинорезистентный диабет, кластер 4 — легкий диабет, связанный с ожирением, кластер 5 — легкий диабет пожилых [2]. В Российской Федерации, как и во всех странах мира, отмечается значимый рост распространенности СД. В базе данных клинико-эпидемиологического мониторинга СД на 01.01.2025 количество пациентов с СД составляет 5 463 982 человек, пациентов с СД2 — 5 046 037 [3]. Однако эти данные недооценивают реальное количество пациентов, поскольку учитываются только выявленные и зарегистрированные случаи заболевания. Самыми опасными последствиями глобальной эпидемии СД являются его системные сосудистые осложнения: нефропатия, ретинопатия, поражение магистральных сосудов сердца, головного мозга, артерий нижних конечностей. Именно эти осложнения являются основной причиной инвалидизации и смертности больных СД [4].
В соответствии с Федеральным законом от 25.12.2018 № 489-ФЗ медицинская помощь оказывается на основе клинических рекомендаций, размещенных в рубрикаторе Министерства здравоохранения Российской Федерации (https://cr.minzdrav.gov.ru).
Индивидуальный подход к каждому пациенту является приоритетным при выборе тактики лечения. Изменение образа жизни (рациональное питание и повышение физической активности) и следование принципам управления заболеванием являются неотъемлемой частью лечения на всем протяжении заболевания [5].
В зависимости от доминирующей клинической проблемы пациента и исходного уровня метаболического контроля определяется терапевтическая тактика сахароснижающей терапии (моно- или комбинированная терапия). При отсутствии атеросклеротических сердечно-сосудистых заболеваний, хронической сердечной недостаточности и хронической болезни почек (ХБП) ранняя комбинированная терапия обеспечивает дополнительные преимущества, влияя на долгосрочное удержание гликемического контроля. При выборе комбинированной терапии учитывается рациональность сочетаний препаратов. Комбинированная терапия метформином и ингибитором дипептидил-пептидазы-4 (иДПП-4) на старте имеет преимущества по сохранению инсулин-секреторной функции [5].
В настоящее время иДПП-4 являются гипогликемическими средствами [6], улучшающими гликемический контроль у пациентов с СД2 путем увеличения концентрации таких гормонов, как глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный пептид (ГИП), блокируя их распад. Это улучшает гликемический контроль у пациентов с СД2 за счет подавления уровня глюкагона и увеличения секреции эндогенного инсулина глюкозозависимым образом [7]. иДПП-4 отличаются низким риском гипогликемий, потенциальным протективным эффектом в отношении β-клеток, не влияют на массу тела, доступны в фиксированных комбинациях с метформином, для большинства препаратов возможно применение на всех стадиях ХБП с соответствующим снижением дозы [8].
Оценка эффективности сахароснижающей терапии проводится по уровню гликированного гемоглобина (НbА1с) каждые 3 мес. Изменение (интенсификация) сахароснижающей терапии при ее неэффективности (т. е. при отсутствии достижения индивидуальных целей НbА1с) выполняется не позднее чем через 6 мес., у лиц с низким риском гипогликемий целесообразно проводить ее не позднее чем через 3 мес. [5].
Ситаглиптин — первый в мире иДПП-4. G.A. Herman et al. [9] изучали фармакодинамику, фармакокинетику и переносимость ситаглиптина у пациентов с СД2. Авторы показали максимальную эффективность ситаглиптина по снижению уровня глюкозы после однократного приема внутрь. Это связано с ингибированием активности ДПП-4 в плазме до 80% или выше и увеличением в 2 раза уровней активного ГПП-1 и ГИП после перорального глюкозотолерантного теста. По данным исследований фармакокинетики и фармакодинамики отмечалось, что ситаглиптин является мощным конкурентным и обратимым ингибитором фермента ДПП-4 с конечным периодом полувыведения 11,8–14,4 ч, выводится преимущественно почками.
В 54-недельном рандомизированном двойном слепом исследовании в параллельных группах была проведена оценка эффективности и безопасности ситаглиптина у пациентов с СД2 и снижением расчетной скорости клубочковой фильтрации (рСКФ) от ≥30 до <50 мл/мин/1,73 м2 и тяжелой ХБП (СКФ <30 мл/мин/1,73 м2), включая пациентов с терминальной стадией ХБП на гемодиализе. Исходные значения показателей HbA1c — от 6,5 до 10%. Пациенты были рандомизированы (2:1) в группы ситаглиптина (в течение 54 нед.) или плацебо (в течение 12 нед.) с последующим активным лечением глипизидом (в течение 42 нед.). В группе ситаглиптина отмечалась хорошая переносимость и эффективный гликемический контроль у пациентов с СД2 и ХБП, включая пациентов с терминальной стадией ХБП на гемодиализе [10].
В сравнительном рандомизированном клиническом исследовании (РКИ) CompoSIT-R у пациентов с СД2 и легкой почечной недостаточностью (рСКФ ≥60, но <90 мл/мин/1,73 м2) и неадекватным контролем гликемии при применении метформина ± сульфонилмочевины проведена оценка эффективности и безопасности иДПП-4 ситаглиптина с ингибитором натрий-глюкозного транспортера-2 (иНГЛТ-2) дапаглифлозином. Результаты CompoSIT-R, опубликованные R. Scott et al. [11] в 2018 г., показали более выраженное снижение уровня HbA1c на терапии ситаглиптином по сравнению с таковым на терапии дапаглифлозином.
Профиль кардиобезопасности ситаглиптина был изучен в клиническом исследовании TECOS (Trial to Evaluate Cardiovascular Oucomes after Treatment with Sitagliptin), включившем 14 671 пациента с СД2 и недостаточным контролем гликемии. Исследование TECOS продемонстрировало, что добавление ситаглиптина к стандартной терапии пациентам с СД2 и установленным ССЗ не увеличивает риск серьезных сердечно-сосудистых событий (смерти, инфаркта миокарда, инсульта, госпитализации по поводу нестабильной стенокардии) по сравнению с плацебо. Исследование также показало, что терапия ситаглиптином способствовала снижению уровня HbA1c и замедлению перехода на инсулинотерапию без повышения риска тяжелой гипогликемии [12].
Результаты обобщенного анализа 25 РКИ (14 611 пациентов) показали, что лечение ситаглиптином не повышает частоту сердечно-сосудистых событий и смертность у пациентов с СД2. Cубанализ продемонстрировал более высокую частоту сердечно-сосудистых событий на приеме препаратов сульфонилмочевины в сравнении с ситаглиптином [13].
Комбинация глиптина с метформином является наиболее рациональной с позиций эффективности, безопасности и низкого риска гипогликемий.
Биоэквивалентность дженерического препарата Ситадиаб® (ситаглиптин производства ОАО «Гедеон Рихтер») была подтверждена в открытом рандомизированном перекрестном двухэтапном исследовании с двумя последовательностями по оценке биоэквивалентности препарата Ситаглиптин, таблетки, покрытые пленочной оболочкой, 100 мг (ОАО «Гедеон Рихтер», Венгрия), и препарата Янувия®, таблетки, покрытые пленочной оболочкой, 100 мг («Мерк Шарп и Доум Б.В.», Нидерланды) после однократного приема натощак здоровыми добровольцами1. Является актуальной оценка клинической эффективности препарата Ситадиаб® (ситаглиптин, ОАО «Гедеон Рихтер») у пациентов с СД2 и коморбидной патологией.
Цель исследования: проанализировать данные по эффективности и безопасности применения комбинированной терапии метформином и ситаглиптином у пациентов с СД2 и коморбидной патологией.
Материал и методы
В данной работе мы представляем собственный опыт применения иДПП-4 ситаглиптин (Ситадиаб® производства ОАО «Гедеон Рихтер»), назначаемого в качестве дополнительной терапии к метформину.
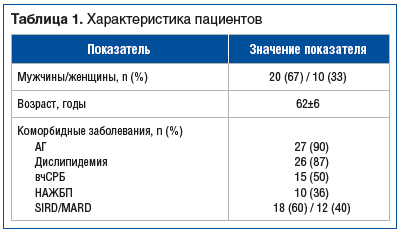
В исследование были включены 30 пациентов (табл. 1) с диагнозом СД2 (кластерная активность: тяжелый инсулинрезистентный диабет (severe insulin-resistant diabetes, SIRD), легкий возрастной диабет (mild age-related diabetes, MARD)) и коморбидной патологией (артериальная гипертензия (АГ), дислипидемия, ожирение, неалкогольная жировая болезнь печени (НАЖБП), низкоинтенсивное неинфекционное воспаление (уровень высокочувствительного С-реактивного белка (вчСРБ) >2 мг/л), которым в условиях реальной клинической практики был назначен ситаглиптин в дозе 100 мг 1 раз в сутки в дополнение к терапии метформином (1500–2000 мг/сут) для снижения или нормализации показателей гликемии.

Критерии включения: пациенты — мужчины и женщины от 18 до 75 лет, предшествующая стабильная терапия метформином на протяжении не менее 3 мес. с уровнем HbA1c выше 7,5%, длительностью СД не более 5 лет, желание и способность пациента участвовать в исследовании, выполнять рекомендации врача для достижения целевых показателей гликемии и биохимического контроля согласно требованиям исследования, наличие коморбидной патологии (любой из перечисленных или их комбинация): ожирения, АГ 1–2 ст., дислипидемии, НАЖБП, низкоинтенсивного неинфекционного воспаления, наличие подписанного информированного согласия пациента на участие в исследовании.
Критерии невключения: отказ от участия в исследовании и/или подписания формы информированного согласия; низкая комплаентность, беременность и/или лактация; наличие серьезных психических или нестабильных соматических заболеваний (патология печени, сердечно-сосудистой системы, легких или почек, онкологические заболевания); гиперчувствительность к компонентам исследуемого препарата или их непереносимость; хронический алкоголизм, наркотическая зависимость; нарушения питания — нервная анорексия или нервная булимия; острый панкреатит; буллезный пемфигоид.
Пациенты наблюдались в клинике амбулаторно. На каждого участника исследования оформлена индивидуальная регистрационная карта (ИРК). Других процедур, выходящих за рамки стандартов лечения и рутинной клинической практики, не проводилось. Для каждого пациента был определен график посещений в соответствии с планом терапии. Пациенты обследованы в первый день обращения к врачу (визит 1 — визит скрининга, начало наблюдения), на визите 2 (День 90) и визите 3 (День 180 — завершение наблюдения). Общая продолжительность терапии для пациента составила 180 сут.
Во время визитов проводилось физикальное обследование пациентов с измерением частоты сердечных сокращений (ЧСС) и артериального давления (АД), окружности талии (ОТ), расчет индекса массы тела (ИМТ) 1 раз в 3 мес. Оценка данных анализов, взятых в рамках рутинной практики, проводилась 1 раз в 3 мес.: уровни глюкозы плазмы натощак (ГПН) и НbА1с, а также на первом и последнем визите — оценка липидного профиля, уровня мочевой кислоты в крови, трансаминаз (аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ)), креатинина, иммунореактивного инсулина (ИРИ) с подсчетом индекса HOMA-IR и индекса HOMA-B, международных индексов фиброза (APRI >1,0 и FIB-4), маркеров воспаления (вчСРБ). Всем пациентам на первом и последнем визитах проводилась оценка сосудистого возраста (СВ) с помощью доступных в клинической практике данных, которые входят в системы оценки сердечно-сосудистого риска (Framingham risk score и ASCORE) [14]. На основании данных крупного популяционнного исследования Framingham Heart Study2 в 2008 г. был предложен алгоритм расчета СВ с использованием данных Framingham risk score по следующим параметрам: пол и возраст пациента, статус курения, уровень общего холестерина (ОХ) и липопротеинов высокой плотности (ЛПВП), уровень систолического АД (САД) и информация о приеме гипотензивных средств, статус СД. Алгоритм расчета СВ для шкалы SCORE был разработан с учетом пола, возраста, статуса курения, уровней АД, ОХ (алгоритм ASCORE) [15, 16].
На визитах проводилась оценка нежелательных явлений (НЯ), включая серьезные НЯ; оценка клинически значимых изменений жизненно важных показателей.
Полученные данные подвергнуты статистической обработке с использованием дескриптивных методов. Оценка изменений показателей от исходного уровня исследована с помощью критериев Стьюдента и Уилкоксона. Статистические гипотезы предварительно не определены, чтобы ограничить риск ложноположительных результатов за счет возможной высокой вариабельности и разнообразия изучаемых данных, что позволит гарантировать достаточный для исследования 5% уровень достоверности.
Результаты исследования
Все пациенты завершили период наблюдения, случаев коррекции дозы ситаглиптина или метформина в течение периода наблюдения зарегистрировано не было. На фоне лечения получены следующие результаты (табл. 2, 3).


У пациентов показатели массы тела и ИМТ стабилизировались с незначительным их снижением. Отмечалось статистически значимое (p<0,05) снижение уровней ГПН и HbA1c в сравнении с исходными значениями (рис. 1). Существенного снижения АД в данном исследовании не отмечалось (САД — на 4,48%, диастолическое АД (ДАД) — на 3,61%).

Использование комбинированной терапии ситаглиптином и метформином у больных СД2 сопровождалось статистически значимыми (p<0,05) положительными изменениями показателей вчСРБ и параметров липидного обмена (рис. 2). Отмечалось также снижение уровней АЛТ и АСТ, не достигшее уровня статистической значимости, при этом влияние терапии на индекс FIB-4 было статистически значимым (p<0,05) (рис. 3).


Изменение показателей инсулинорезистентности (снижение показателей HOMA-IR, повышение — HOMA-B) отличалось в зависимости от фенотипа пациентов. У пациентов кластера MARD отмечалось более выраженное снижение показателей HOMA-IR и повышение — HOMA-B, чем у пациентов кластера SIRD (рис. 4).

На фоне комбинированной терапии ситаглиптином и метформином отмечалось снижение неинвазивных показателей фиброза печени (FIB-4) у пациентов с более выраженным проявлением инсулинорезистентности (кластер SIRD) по сравнению с пациентами кластера MARD. При этом отсутствовала динамика показателя APRI (см. табл. 2).
Наблюдалось небольшое, но статистически значимое снижение СВ, рассчитанного по алгоритмам ASCORE и по Framingham risk score, при этом стоит отметить, что эффективность препарата не зависела от кластера СД2 у пациента (табл. 4).

На протяжении всего исследования ни у одного из пациентов в обеих группах не было зарегистрировано ни одного НЯ.
Обсуждение
Так как СД2 является гетерогенным заболеванием, выделение фенотипов СД2 способствовало улучшению прогноза риска развития осложнений, метаболических нарушений и приоритета выбора персонализированной терапии. В Алгоритмах 2025 г. определены ключевые показатели для мониторинга и оценки качества гликемического контроля (уровень НbА1с) [5].
Применение комбинированной терапии (препараты метформин и ситаглиптин) на протяжении 6 мес. сопровождалось статистически значимым улучшением показателей гликемии. Снижение показателей ГПН и НbА1с отмечалось уже через 3 мес. от начала лечения, при этом ранее показана способность ситаглиптина удерживать гликемический контроль на горизонте 10-летнего наблюдения [17].
Результаты проведенного исследования продемонстрировали, что применение комбинированной терапии на протяжении 6 мес. у пациентов с СД2 сопровождалось статистически значимым снижением выраженности инсулинорезистентности и уровня вчСРБ, достижением целевых значений АД и липидного профиля при сопоставлении с исходными данными, что подтверждает полученные ранее данные о положительном долгосрочном влиянии ситаглиптина на инсулинорезистентность, воспаление и функцию β-клеток [17–19]. При этом влияние препарата на инсулинорезистентность зависело от фенотипа пациентов — у пациентов кластера MARD отмечалось более выраженное снижение показателей HOMA-IR и повышение — HOMA-B, чем у пациентов кластера SIRD. Таким образом, у пациентов кластера MARD назначение ситаглиптина является патогенетически обоснованным [20, 21].
В настоящем исследовании на фоне комбинированной терапии ситаглиптином и метформином было также отмечено снижение неинвазивных показателей фиброза печени (FIB-4) у пациентов с более выраженным проявлением инсулинорезистентности (кластер SIRD) по сравнению с пациентами кластера MARD. Влияние ситаглиптина на течение НАЖБП, независимое от наличия СД2, ранее было выявлено в исследовании с гистологическим подтверждением [22], однако исследование реальной клинической практики не выявило положительного влияния на неинвазивные показатели фиброза печени [23]. Ранее было показано, что эффект ситаглиптина в снижении показателей фиброза был значительно более выражен у лиц с нормальной и избыточной массой тела, чем у лиц с ожирением, тогда как влияние ситаглиптина на уровни печеночных ферментов было значительнее среди пациентов с избыточной массой тела / ожирением [22]. Таким образом, влияние фенотипа пациента на эффективность антидиабетических препаратов, в частности ситаглиптина, в отношении прогрессирования НАЖБП нуждается в дальнейшем изучении.
Стоит отметить также положительное воздействие препарата на СВ, не зависящий от исходного фенотипа пациента.
Заключение
Полученные данные свидетельствуют об эффективности комбинированной терапии (препараты метформин и ситаглиптин) у пациентов с СД2 и сопутствующими метаболическими нарушениями. Применение комбинированной терапии на протяжении 6 мес. позволило стабилизировать АД, массу тела, показатели углеводного обмена, липидный спектр, существенно снизились проявления инсулинорезистентности и значения вчСРБ. Назначение ранней комбинированной терапии, наряду с хорошей переносимостью и отсутствием зарегистрированных случаев значимых лекарственных взаимодействий и НЯ, позволяют у больных СД2 (длительность СД — до 5 лет) достичь значимых комплексных результатов.
1Реестр разрешенных клинических исследований. Государственный реестр лекарственных средств. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/CIPermissionMini.aspx?CIStatementGUID=9484bf6d-bd29-49aa-a811-07c749f7cd…, Т (дата обращения: 15.09.2025).
2FHS Cardiovascular Disease (10-year risk) (Electronic resource.) URL: https://www.framinghamheartstudy.org/fhs-risk-functions/cardiovascular-disease-10-year-risk (access date: 15.09.2025 г.).