Введение
Остеопороз (ОП) считается одним из наиболее распространенных метаболических заболеваний костной ткани, особенно среди людей старше 50 лет, в большей степени — у женщин в постменопаузе. Основное клиническое проявление — переломы вследствие хрупкости (наиболее часто — проксимальный отдел бедра, тела позвонков), которые ведут к снижению качества жизни, инвалидизации и высокой смертности и составляют значимую медицинскую проблему во всем мире, включая Россию. По данным Международного фонда остеопороза (IOF), примерно каждая третья женщина и каждый пятый мужчина старше 50 лет перенесут остеопоротический перелом [1, 2].
Статистические данные указывают на высокую распространенность переломов среди лиц пожилого возраста — ежегодно в мире фиксируется более 37 млн случаев переломов у людей старше 55 лет [3–5]. При этом около 75% всех переломов у пациентов старше 65 лет приходится на типичные остеопоротические локализации: проксимальный отдел бедра, позвонки и предплечье. Переломы шейки бедра рассматриваются как одна из наиболее значимых причин инвалидизации в геронтологической популяции. Согласно эпидемиологическим исследованиям риск летальности вследствие данного типа перелома в течение 1–2-го года после травмы достигает 20–30%, причем у женщин наблюдается повышение вероятности смерти в последующие годы на 10–20%. Значительная часть пациентов, перенесших крупные остеопоротические переломы, нуждается в долговременном уходе и реабилитации. С учетом демографических тенденций прогнозируется дальнейший рост бремени остеопоротических переломов, а также увеличение нагрузки на систему здравоохранения в связи с возрастающей продолжительностью жизни и увеличением численности лиц пожилого возраста [6]. Данное заключение подчеркивает критическую необходимость повышения эффективности профилактики и лечения ОП. Растущее число переломов создает значительную нагрузку на систему здравоохранения и обусловливает важность внедрения современных терапевтических стратегий ОП. Систематическое выявление лиц из групп высокого риска (особенно женщин старше 65 лет и мужчин старше 70 лет) позволяет своевременно начать профилактику и терапию.
Назначение антирезорбтивных и анаболических препаратов (например, бисфосфонатов, деносумаба, терипаратида) значительно снижает риск повторных переломов бедра и других типичных остеопоротических повреждений. Современные программы должны включать коррекцию дефицита витамина D, кальция, контроль факторов падения, физическую активность и реабилитацию. Поддержка приверженности лечению также играет ключевую роль в снижении смертности и инвалидизации после остеопоротических переломов [7].
Бисфосфонаты представляют собой наиболее широко используемые препараты для терапии ОП и снижения риска связанных с ним переломов. В данную группу входят как пероральные формы — алендроновая, ризедроновая и ибандроновая кислота, так и парентеральные — золедроновая и ибандроновая кислота. В настоящее время значительное число пациентов с ОП получают бисфосфонаты на протяжении длительного периода. Это обстоятельство обусловливает появление вопросов, касающихся устойчивости клинического эффекта, вероятности возникновения нежелательных явлений при длительном приеме, а также разумности прекращения или временной отмены терапии [8].
В работе L. Dalle Carbonare et al. [9] отмечается, что золедроновая кислота обладает самой высокой аффинностью к костной ткани среди бисфосфонатов благодаря уникальному строению боковой цепи (гетероциклическое кольцо с двумя атомами азота), что усиливает антирезорбтивный эффект и увеличивает продолжительность действия препарата. В биохимических исследованиях именно золедроновая кислота продемонстрировала максимальное ингибирование фермента FPP-синтазы — ключевого для функции остеокластов.
По данным метаанализа и систематического обзора [10], внутривенное введение золедроновой кислоты обеспечивает лучшую биодоступность, значительно отличающуюся от пероральных форм других бисфосфонатов.
Согласно метаанализу [11] золедроновая кислота оказалась наиболее эффективной в предотвращении как вертебральных, так и невертебральных переломов по сравнению с алендронатом, ризедронатом, ибандронатом и другими бисфосфонатами (относительный риск (ОтнР) 0,45–0,65, p<0,05). Золедроновая кислота занимает первое место по предотвращению всех типов переломов [11]. Данные одного из крупнейших рандомизированных исследований HORIZON Pivotal Fracture Trial (PFT) свидетельствуют, что за 36 мес. лечения золедроновой кислотой отмечалось снижение риска новых морфометрических вертебральных переломов на 70%, переломов шейки бедра — на 41%, нестабильных переломов — на 25% [12, 13]. В этом исследовании также было показано, что введение 1 раз в год золедроновой кислоты после хирургического лечения низкоэнергетического перелома бедра привело к снижению общей смертности: риск смерти был ниже в группе золедроновой кислоты, чем в группе плацебо (общая смертность составила 9,6% против 13,3%, разница статистически значима, отношение рисков (ОР) 0,72, 95% доверительный интервал (ДИ) 0,56–0,93, p=0,01 [14]. Исследование [15] показало, что смертность среди пациентов, получавших бисфосфонаты, была на 15% ниже по сравнению с контрольной группой (ОР 0,85, 95% ДИ 0,79–0,91) при медиане наблюдения 2,8 года.
В современной литературе активно обсуждаются вопросы кардиобезопасности и переносимости бисфосфонатов, в частности золедроновой кислоты, при долгосрочном лечении ОП. Метаанализ 9 рандомизированных клинических исследований у женщин с первичным ОП показал, что золедроновая кислота может повышать относительный риск фибрилляции предсердий (ОтнР 1,21, 95% ДИ 0,99–1,47, р=0,06) и аритмий (ОтнР 1,30, 95% ДИ 1,11–1,52; р=0,001) по сравнению с плацебо. Однако существенного повышения риска серьезных сердечно-сосудистых событий, инфаркта миокарда, инсульта не выявлено [16]. Согласно данным метаанлиза [17] риск фибрилляции предсердий для золедроновой кислоты был умеренно повышен (отношение шансов (ОШ) 1,24, 95% ДИ 0,96–1,61), но не был значимо выше для других бисфосфонатов или по отношению к плацебо. Общий риск больших сердечно-сосудистых событий не увеличивался [17]. Таким образом, метаанализы демонстрируют умеренное повышение частоты фибрилляции предсердий после инфузий золедроновой кислоты у пациентов с ОП, при этом существенного увеличения смертности или крупных сердечно-сосудистых событий выявлено не было, что требует персонифицированного подхода к терапии.
Пирогенные (острофазовые) реакции остаются одной из наиболее обсуждаемых побочных реакций применения золедроновой кислоты. Эти реакции проявляются как комплекс симптомов, включающий лихорадку, озноб, гриппоподобный синдром, скелетно-мышечные боли и общее недомогание, обычно развивающиеся в течение 24–72 ч после первой инфузии препарата. Согласно современным исследованиям патогенез острой фазы обусловлен активацией γ,δ-T-лимфоцитов и выбросом провоспалительных цитокинов: интерлейкина 6, фактора некроза опухоли α и интерферона γ, концентрация которых достигает максимума через 28–36 ч после введения золедроновой кислоты и нормализуется к концу первых 3–5 дней терапии. Развернутая острофазовая реакция на первую инфузию золедроновой кислоты может служить маркером высокой эффективности препарата в снижении риска позвонковых переломов. Согласно ключевому анализу данных HORIZON-PFT [12] у женщин с ОП, получавших золедроновую кислоту, развитие выраженной пирогенной реакции (острофазовой реакции, ОФР) в течение 3 дней после первой инфузии ассоциировалось с существенно более выраженным снижением риска новых позвонковых переломов. Среди пациенток, перенесших ОФР, риск новых морфометрических переломов тела позвонка был снижен на 81% по сравнению с группой плацебо (ОШ 0,19), тогда как у перенесших инфузию без ОФР — на 62% (ОШ 0,38; p для взаимодействия — 0,01). В самой группе золедроновой кислоты риск вертебральных переломов был на 51% ниже у женщин с ОФР по сравнению с теми, у кого ОФР не возникала (2,2% против 4,3%; ОШ 0,49, p<0,001) [12].
В 2019 г. был утвержден отечественный дженерический препарат золедроновой кислоты Остеостатикс® (регистрационное удостоверение ЛП-005585 от 13.06.2019). Он выпускается в форме готового инфузионного раствора, который содержит 5 мг безводной золедроновой кислоты в 100 мл воды для инъекций. С 2020 г. Остеостатикс® активно внедряется в клиническую практику в рамках программы импортозамещения.
Цель исследования: оценка безопасности и переносимости дженерического препарата золедроновой кислоты у больных с постменопаузальным ОП.
Материал и методы
В 2021–2023 гг. проведено проспективное когортное исследование, на которое было получено одобрение этического комитета ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, все женщины подписали информированное согласие на участие в исследовании и обработку обезличенных персональных данных. Осмотрены 70 женщин с постменопаузальным ОП, обратившихся в центр остеопороза ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, и проанализированы данные их медицинских карт. Медиана возраста составила 62 [57; 67] года, роста — 165 [162; 170] см, массы тела — 79,3 [74,0; 86,0] кг, длительности постменопаузы — 14,5 [10,0; 20,0] года.
Критерии включения: постменопаузальный ОП, подписанное и датированное письменное информированное согласие на участие в исследовании, нахождение на амбулаторном лечении в постменопаузе с диагнозом «постменопаузальный остеопороз» (спонтанная аменорея в течение более 12 мес. или хирургическая менопауза минимум за 6 нед. до начала скрининга), на момент скрининга Т-критерий минеральной плотности кости (МПК) поясничных позвонков в диапазоне от -2,5 до -5,0 SD по результатам централизованной экспертной оценки показателей двухэнергетической рентгеновской абсорбциометрии (DXA).
Критерии исключения: вторичный ОП, наличие в анамнезе гиперчувствительности к любым компонентам бисфосфонатов и костно-анаболической терапии, злокачественные новообразования, острые или хронические в стадии обострения воспалительные заболевания, сосудистые заболевания мозга в острой стадии (ишемический или геморрагический инсульт), хроническая сердечная недостаточность IV функционального класса по классификации Нью-Йоркской кардиологической ассоциации (NYHA), инфекционные заболевания, анемии средней или тяжелой степени, коагулопатии.
Минеральную плотность кости оценивали на основании DXA Hologic Discoveri Wi в двух точках: поясничном отделе позвоночника (L1–L4) и шейке бедренной кости.
Внутривенные инфузии препарата золедроновой кислоты (Остеостатикс®) 5 мг / 100 мл проводили 1 раз в год. Период наблюдения составил 3 года. Всем женщинам дополнительно рекомендовали прием препаратов кальция (500–1000 мг/сут) и витамина D (2000 МЕ/сут) — дозировки определяли с учетом уровня ежедневного поступления кальция с пищей и концентрации витамина D в крови.
Для мониторинга безопасности все участницы проходили оценку рутинных лабораторных показателей, включая общий клинический анализ крови и биохимическое исследование, в амбулаторных условиях. При выявлении отклонений от референсных значений или ухудшении общего состояния пациенткам рекомендовалось обратиться в специализированный центр ОП для проведения дополнительного обследования и коррекции терапии. Биохимический анализ крови включал определение показателей общего кальция, фосфора, щелочной фосфатазы (ЩФ), аланинаминотрансферазы, аспартатаминотрансферазы и креатинина, скорость клубочковой фильтрациии по формуле CKD-EPI до введения препарата, через 1 и 3 мес. после инфузии. Также в динамике ежегодно оценивали маркеры костного обмена: паратгормон, витамин D, кальций общий, через 1 и 3 мес. — в плановом порядке, дезоксипиридинолин в моче, C-концевой телопептид коллагена I типа (CTX), остеокальцин. Для оценки состояния сердечно-сосудистой системы всем пациенткам при каждом визите проводили электрокардиографию, измерение артериального давления и частоты пульса, а также опрос о наличии жалоб и общее клиническое обследование. Оценка переносимости включала регистрацию всех нежелательных реакций, связанных с введением препарата.
Статистический анализ проводили с использованием программ IBM SPSS Statistics 26 (SPSS Inc., США) и StatTech 3.1.8 (ООО «Статтех», Россия). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова — Смирнова. Количественные показатели описывали с помощью медианы (Me), нижнего и верхнего квартилей [Q1; Q3]. Категориальные данные выражали с указанием абсолютных значений и долей в процентах. При сравнении двух количественных показателей с распределением, отличным от нормального, в двух связанных группах использовали критерий Уилкоксона. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
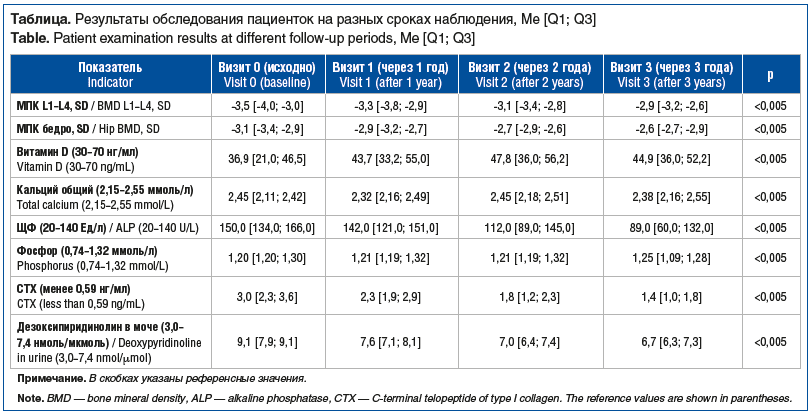
Характеристика пациенток, находившихся под наблюдением в течение 3 лет, представлена в таблице.
![Таблица. Результаты обследования пациенток на разных сроках наблюдения, Me [Q1; Q3] Table. Patient examination results at different follow-up periods, Me [Q1; Q3] Таблица. Результаты обследования пациенток на разных сроках наблюдения, Me [Q1; Q3] Table. Patient examination results at different follow-up periods, Me [Q1; Q3]](https://www.rmj.ru/upload/medialibrary/b4a/smgl6eya63xxqfe53223t311hj51f8ti/720-1.png)
Представленные данные демонстрируют выраженные изменения биохимических и функциональных параметров костного обмена у пациенток в ходе наблюдения. Согласно результатам у большинства обследованных женщин отмечено статистически значимое повышение МПК как в поясничном отделе позвоночника (L1–L4), так и в проксимальном отделе бедренной кости, что указывает на положительный ответ на терапию. Улучшение МПК на протяжении 1 года и 2 лет наблюдения сопровождается нормализацией биохимических маркеров ремоделирования кости. Концентрация витамина D в сыворотке крови увеличилась, приближаясь к целевым значениям, что отражает адекватную компенсацию дефицита и важное влияние на метаболизм костной ткани. При этом уровни общего и ионизированного кальция оставались в пределах физиологической нормы, что указывает на безопасность проводимой терапии без признаков гиперкальциемии. Динамика уровня ЩФ и CTX подтверждает снижение интенсивности костной резорбции, особенно на фоне стабилизации витамин D-кальциевого обмена.
Также отмечено умеренное увеличение уровней магния и фосфора, что способствует поддержанию метаболического равновесия и указывает на улучшение минерального обмена в целом. Изменения содержания остеокальцина и дезоксипиридинолина отражают снижение скорости костного ремоделирования и переход от катаболического к более анаболическому типу метаболической активности кости. Полученные данные свидетельствуют о комплексном положительном эффекте проводимой терапии на МПК.
В ходе проведенного исследования у 15 (21,4%) пациенток было зафиксировано повышение температуры тела до 37 °C в первые 3 дня. Кроме того, у 5 (7,1%) наблюдались артралгии и миалгии. Эти побочные реакции успешно купировались приемом парацетамола в дозе 100 мг/сут на протяжении 3 дней. Побочные эффекты носили кратковременный характер и не требовали отмены терапии.
По опубликованным международным данным (в т. ч. большие рандомизированные, регистрационные и пострегистрационные исследования, обзоры), острые постинфузионные реакции (лихорадка, миалгия, артралгия) отмечаются у 18–48% пациентов, чаще всего, около 20–25% пациентов, — после первой инфузии. Симптомы возникают обычно в течение первых 1–3 суток, продолжаются не более 2–3 дней, хорошо контролируются назначением парацетамола или нестероидных противовоспалительных препаратов [18, 19]. Таким образом, выявленные в нашем исследовании побочные эффекты по частоте, характеру и исходам сопоставимы с таковыми в международных исследованиях и считаются ожидаемыми при применении золедроновой кислоты у пациенток с ОП.
Следует отметить, что выраженность побочных реакций после инфузий препарата Остеостатикс® в настоящем исследовании оказалась заметно ниже у пациенток, ранее получавших персонализированные курсы других бисфосфонатов. Эти данные согласуются с данными международных и российских исследований, согласно которым частота и выраженность ОФР существенно снижаются при повторных введениях бисфосфонатов относительно первичного использования препарата. Метаанализ исследований применения золедроновой кислоты показывает, что риск острого постинфузионного синдрома (лихорадка, миалгия, артралгия, гриппоподобный синдром) существенно выше при первой инфузии и заметно снижается при последующих повторных введениях, а также у пациенток с предшествующим приемом препаратов этого класса [10]. В ходе проведения исследования неблагоприятных явлений со стороны сердечно-сосудистой системы на фоне проводимой терапии зарегистрировано не было.
Заключение
В ходе проведенного клинического исследования была продемонстрирована высокая терапевтическая эффективность и удовлетворительный профиль безопасности инфузионного применения дженерического препарата золедроновой кислоты для лечения постменопаузального ОП у женщин. За период наблюдения отмечено статистически значимое повышение МПК как в поясничном отделе позвоночника, так и в проксимальном отделе бедренной кости, сопровождавшееся улучшением биохимических маркеров костного обмена. Частота и степень выраженности ОФР соответствовали данным крупных международных рандомизированных исследований и метаанализов, причем у пациенток с предшествующим опытом персонифицированной бисфосфонатной терапии такие реакции носили менее выраженный и обратимый характер, часто эффективно купировались с помощью симптоматической коррекции и не становились основанием для отмены препарата. Сопоставление полученных данных с результатами международных клинических рекомендаций и метаанализов подтверждает эффекты золедроновой кислоты в профилактике остеопоротических переломов, повышении МПК и замедлении прогрессирования заболевания.
Сведения об авторах:
Жугрова Елена Сергеевна — к.м.н., доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-8622-5205
Мазуров Вадим Иванович — д.м.н., академик РАН, заслуженный деятель науки Российской Федерации, профессор, директор НИИ ревматологии и заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-0797-2051
Беляева Ирина Борисовна — д.м.н., профессор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9126-3639
Шиманьски Даниэль Анджеевич — к.м.н., ассистент кафедры терапии госпитальной с курсом аллергологии и иммунологии имени ак. Черноруцкого с клиникой ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000‑0002‑6903‑2217
Гумерова Виктория Евгеньевна — к.м.н., ассистент кафедры госпитальной терапии и кардиологии им. М.С. Кушаковского ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0003-2805-3748
Контактная информация: Жугрова Елена Сергеевна, e-mail: jugrova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.08.2025.
Поступила после рецензирования 02.09.2025.
Принята в печать 25.09.2025.
About the authors:
Elena S. Zhugrova — C. Sc. (Med.), associate professor of the E.E. Eikhvald Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-8622-5205
Vadim I. Mazurov — Dr. Sc. (Med.), Academician of the Russian Academy of Sciences, Honored Scientist of the Russian Federation, Professor, Chief Scientific Consultant, Director of the Research Institute of Rheumatology, Head of the Department of Therapy, Rheumatology, Examination of Temporary Disability and Quality of Medical Care with a course in Hematology and Transfusiology named after E.E. Eichwald, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-0797-2051
Irina B. Belyaeva — Dr. Sc. (Med.), Professor of the E.E. Eikhvald Department of Therapy, Rheumatology, Temporary Disability Examination and Quality of Medical Care, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9126-3639
Daniel A. Shimansky — C. Sc. (Med.), assistant of the Department of Hospital Therapy with a Course of Allergology and Immunology named after Academician Chernorutsky with Clinical Department, Pavlov First Saint-Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-6903-2217
Victoria E. Gumerova — C. Sc. (Med.), assistant of the Department of Hospital Therapy and Cardiology named after M.S. Kushakovsky, North-Western State Medical University named after I.I. Mechnikov; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0003-2805-3748
Contact information: Elena S. Zhugrova, e-mail: jugrova@ mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.08.2025.
Revised 02.09.2025.
Accepted 25.09.2025.