Введение
Аденомиоз матки (АМ) — это патология, при которой эндометриальные железы и строма присутствуют в миометрии, приводя к его гипертрофии. АМ является одним из наиболее распространенных гинекологических заболеваний у женщин репродуктивного возраста, частота его колеблется от 20 до 62% и зависит от возрастной группы и методов диагностики [1].
Патогенез развития АМ остается неизвестным. В настоящее время существует 4 теории, предполагающие, что АМ возникает вследствие эндомиометриальной инвагинации эндометрия (1), de novo из остатков мюллеровых протоков (2), вследствие миграции эндометриальных клеток в миометрий в связи с микротравмами эндометриально-миометриальной переходной зоны (3) или в результате ретроградного заброса эндометриальных клеток с менструацией (4) [2]. Эстрогены и прогестерон вносят свой вклад в патофизиологию АМ, оказывая митогенное действие как на эндометриоидные гетеротопии, так и на гладкомышечные клетки матки [3].
Для эндометрия при АМ характерен целый комплекс молекулярно-биологических изменений, проявляющихся повышенной экспрессией ароматазы (P450arom), дисбалансом в образовании рецепторов к эстрогенам (ER) и прогестерону (PR), снижением количества пиноподий и апоптоза [4]. В исследовании Y.Y. Zeng et al. [5] было выявлено значимое увеличение количества ER, а М.К. Mehasseb et al. [6] сообщили о преобладании экспрессии эстрогеновых β-рецепторов (ERβ) и снижении уровня PR. Экспрессия других ключевых факторов, таких как ген BCL2, супероксиддисмутазы, фактор стимуляции колоний гранулоцитарных макрофагов и KRAS в аденомиотических клетках отличается от эутопических эндометриальных желез, что нарушает местный гомеостаз иммунной системы и может влиять на репродуктивную функцию [7].
Аденомиоз ассоциирован с повышенным риском бесплодия и невынашивания беременности [8]. Частота бесплодных браков в России составляет от 17,2 до 24%1. Одним из факторов бесплодия является эндометриоз различных локализаций. Наличие АМ не только снижает частоту наступления беременности, но и оказывает негативное влияние на ее пролонгирование. В основе ранних репродуктивных потерь при АМ лежит нарушение процессов нидации в связи с местными гормональными и иммунологическими нарушениями в эндометрии [8].
Ранее выполненные исследования под руководством профессора Ю.Э. Доброхотовой показали, что применение экзогенной цитокинотерапии способствует нормализации экспрессии факторов врожденного иммунитета, ER и PR, улучшению репарации и ангиогенеза в эндометрии женщин, страдающих хроническим эндометритом [9, 10]. В связи с этим было предпринято настоящее пилотное исследование, целью которого явилась попытка улучшения рецептивности эндометрия у пациенток с АМ путем применения экзогенной цитокинотерапии.
Материал и методы
Проведено пилотное проспективное исследование, включившее 67 пациенток репродуктивного возраста. В основную группу было включено 27 больных с АМ, в контрольную группу — 40 здоровых женщин.
Критерии включения в основную группу: возраст 25–41 год; заинтересованность в наступлении беременности; наличие АМ по данным ультразвукового исследования (УЗИ); отсутствие инфекций, передающихся половым путем (ИППП), воспалительного и невоспалительного патологического процесса во влагалище и шейке матки; отсутствие внутриматочных вмешательств (раздельное диагностическое выскабливание, вакуумное опорожнение полости матки) в течение 3 мес. до момента включения в исследование; отсутствие декомпенсированной соматической патологии (сахарный диабет, гипотиреоз, ожирение, системные заболевания); отсутствие известных аллергических реакций и непереносимости компонентов препарата Суперлимф®.
Критерии исключения из основной группы: наличие пороков развития матки, миомы матки больших размеров и с субмукозной локализацией узла; наличие онкологических заболеваний в анамнезе и в настоящее время; наличие ИППП в настоящее время или в течение 3 мес., предшествующих исследованию.
Критерии включения в контрольную группу: возраст от 20 до 40 лет; отсутствие любых форм эндометриоза, ИППП; отсутствие в анамнезе внутриматочных вмешательств, внутриматочной спирали, гинекологической и значимой соматической патологии (иммунодефицит, сахарный диабет, ожирение, гипотиреоз, системные заболевания).
Пациентки из основной и контрольной групп дали письменное информированное согласие на участие в исследовании, использование биологического материала и обработку персональных данных. Исследование было одобрено биоэтической комиссией «НИИМЧ им. акад. А.П. Авцына» ФГБНУ «РНЦХ им. акад. Б.В. Петровского» (протокол № 35 (11) от 23.03.2022).
Работа проводилась в 2 этапа. На первом этапе изучалась рецептивность эндометрия на основании материала, полученного при помощи пайпель-аспирационной биопсии, выполненной на 19–24-й день цикла. На втором этапе пациенткам основной группы назначали препарат Суперлимф® 25 ЕД по 1 свече вагинально на ночь в течение 2 мес. (с перерывом на менструальное кровотечение). Сразу после окончания курса введения препарата, также на 19–24-й день цикла, проводили повторный забор аспирата эндометрия.
Активным веществом препарата Суперлимф® является белково-пептидный комплекс свиных лейкоцитов (Центр иммунотерапии «Иммунохелп»), представляющих собой универсальный стимулятор иммунной системы с активностью фактора, угнетающего миграцию макрофагов, интерлейкинов 1 и 6, фактора некроза опухоли, трансформирующего фактора роста, секретируемых лейкоцитами периферической крови свиньи.
Методы исследования. УЗИ выполняли на аппарате WS80A-RUS (Samsung Medison) с использованием конвексного датчика CA1-7A (1–7 МГц, угол обзора 70°, монокристальный) и внутриполостного датчика EA2-11В (2–11 МГц, угол обзора 150°). Оценку стадии АМ проводили в соответствии с классификацией академика РАН Л.В. Адамян (1998).
Иммуногистохимическое (ИГХ) исследование проводили с использованием материала из полости матки, полученного путем пайпель-аспирационной биопсии, выполненной на 19–24-й день цикла. Для исключения контаминации образца микроорганизмами выполняли антисептическую обработку стенок влагалища и влагалищной порции шейки матки, после чего в полость матки вводили стерильный зонд Pipelle de Cornier. Полученный клинический образец помещали в пробирку типа «Эппендорф», содержащую транспортную среду, и в течение 2–4 ч доставляли в коммерческую лабораторию с соблюдением температурного режима (4 °С). При проведении ИГХ-окраски использовали стандартные первичные антитела: моноклональные антитела к ER, клон 1D5 (Dako), к PR, клон SP2 (Dako).
При ИГХ-исследовании оценивали количество пиноподий (в %), экспрессию ER (в эпителии желез и строме) и PR (в эпителии желез и строме).
Статистический анализ. Статистическую обработку полученных данных проводили с использованием программы Sigma Stat 3.5 (Systat Software, Inc., США). Использованы параметрические методы анализа, так как выборка соответствовала нормальному распределению. Проверку нормальности распределения количественных признаков осуществляли с использованием критерия Колмогорова — Смирнова.
При межгрупповом сравнении использован критерий Краскела — Уоллиса с определением одного общего значения р для всех групп. Затем для сравнений с положительным результатом (р<0,05) проводились попарные сравнения групп с помощью критерия Манна — Уитни с поправкой Бонферрони для уточнения того, между какими именно группами имеются различия. Сравнение количественных данных в двух несвязанных группах выполнено с применением U-критерий Манна — Уитни. Для показателей, характеризующих качественные признаки, указывали абсолютное значение и относительную величину в процентах, проверку статистических гипотез о совпадении наблюдаемых и ожидаемых частот осуществляли с использованием точного критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Возраст пациенток основной группы был от 25 лет до 41 года (33±3,9 года), в контрольной группе — от 25 до 30 лет (25±3,7 года).
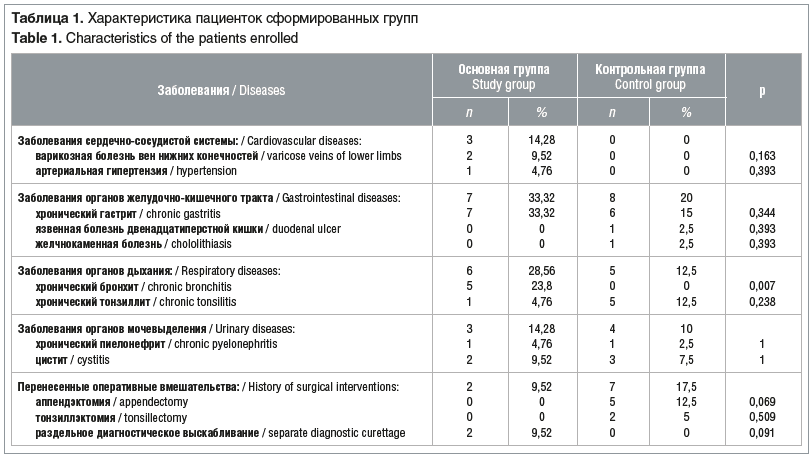
Данные о гинекологическом и соматическом анамнезе приведены в таблице 1. В структуре экстрагенитальных заболеваний у всех женщин существенное место занимала патология органов дыхания (28,56 и 12,5% соответственно) и желудочно-кишечного тракта (33,32 и 20% соответственно). Суммарно заболевания органов мочевыделительной (14,28 и 10%) и сердечно-сосудистой (14,28 и 0%) систем встречались с одинаковой частотой в обеих группах.

Анализ акушерского анамнеза пациенток основной и контрольной групп не выявил значимых различий. Влагалищные роды были у 64,29 и 65,57% пациенток, артифициальный аборт отмечался у 19,05 и 18,03%, самопроизвольный выкидыш был зарегистрирован у 7,14 и 11,48% пациенток соответственно (р≥0,05).
Наиболее распространенными гинекологическими заболеваниями были эктопия шейки матки (77,8 и 80%), кандидозный вагинит (59,26 и 67,5%), бактериальный вагиноз (14,81 и 15%) и дисменорея (11,11 и 12,5%) (во всех случаях р≥0,05). Согласно критериям включения в 100% случаев у пациенток основной группы имелись клинико-инструментальные признаки АМ (табл. 2).

У всех пациенток основной группы была выявлена диффузная неоднородность миометрия, что является универсальным неспецифическим УЗ-признаком АМ. Наличие нечеткости контура эндометрия в зоне перехода отмечалось у 37,03% и свидетельствовало о развитии II стадии АМ, при которой происходит инвазия эндометрия в миометрий. У 6 (22,22%) пациенток присутствовали гипоэхогенные включения в миометрии, что характерно для очаговой формы АМ, чаще соответствующей III стадии заболевания. У 3 (11,1%) пациенток визуализированы эхогенные линии, что считается УЗ-признаком II–III стадии АМ. Как видно из представленных в таблице 3 данных, в основной группе преобладали пациентки с I стадией заболевания.

Анализ результатов ИГХ-исследования выявил наличие значимых различий в уровне экспрессии рецепторов эстрогена, прогестерона и количестве пиноподий у пациенток с АМ по сравнению с контролем. Исходно на фоне АМ отмечено снижение количества пиноподий в 1,3 раза, повышение уровня ER (в 2,6 раза в строме и в 2,3 раза в эпителии желез) и PR (в 1,5 раза в строме и в 1,2 раза в эпителии желез) (табл. 4).

При оценке динамики ИГХ-показателей в основной группе пациенток после цитокинотерапии были выявлены достоверные изменения ряда параметров. Уровень пиноподий увеличился с 41,5 до 45,3% (p=0,02), однако был все еще ниже показателей контрольной группы (53,4±17,5%). Экспрессия ER в строме достоверно увеличилась с 176,4 до 192,2 (p=0,02), а в железистом эпителии — с 170,8 до 189,3 (p=0,01). При этом в контрольной группе уровни ER в строме и эпителии желез были значимо ниже (67,5±12,1 и 74±18,6 соответственно). Аналогичные изменения отмечены в отношении PR: в строме их экспрессия увеличилась с 190,1 до 236,4 (p=0,01), а в железистом эпителии — с 127,8 до 179,7 (p=0,01). При этом в контрольной группе PR были значимо ниже (131,5±12,2 и 108,3±25,1 соответственно).
Дополнительный анализ уровня экспрессии рецепторов в эндометрии в зависимости от стадии АМ позволил выявить некоторые закономерности. При I стадии заболевания экспрессия рецепторов повышена в меньшей степени, чем при II и III стадиях (р>0,05) (см. рисунок). По мере прогрессирования заболевания отмечается увеличение экспрессии рецепторов. Наблюдается обратная зависимость между стадией АМ и рецептивностью эндометрия: по мере увеличения стадии АМ ухудшаются морфологические и молекулярные маркеры рецептивности.

Обсуждение
В основе ведущей теории развития АМ лежит инвагинация базальных клеток эндометрия в миометрий, предполагающая индуцированный эстрогенами переход эпителия в мезенхиму, при котором эпителиальные клетки эндометрия утрачивают свойства межклеточной адгезии и приобретают мезенхимальные характеристики с повышенной способностью к миграции [11].
В настоящее время можно считать общепринятым, что при АМ формируется локальная гиперэстрогения, связанная с повышением экспрессии ERα и ERβ в эутопическом эндометрии [12]. Пока неизвестно, по какой причине измененная ткань экспрессирует повышенное количество ER, рассматриваются варианты развития генетических полиморфизмов, обеспечивающих данный процесс.
Несмотря на то, что АМ считается гормонозависимым заболеванием, он часто невосприимчив к медикаментозному гормональному лечению [13]. Гормоны регулируют изменения в правильно расположенном эндометрии, следовательно, нарушенная экспрессия рецепторов гормонов при АМ может объяснить, почему у некоторых женщин АМ невосприимчив к гормональному лечению.
Концепция резистентности к прогестерону как потенциальному фактору патогенеза АМ и бесплодия возникла в связи с накоплением данных об ограниченной эффективности применения прогестагенных препаратов у женщин с АМ [11]. Предполагается, что это может быть связано как со снижением экспрессии PR, так и с развитием их функциональной несостоятельности [14].
Данные об уровне экспрессии PR при АМ неоднозначны. В работах M. Mehasseb et al. [6], N. Samartzis et al. [15] сообщалось о сохранном или увеличенном уровне экспрессии PR, а в исследовании K.N. Khan et al. [16] — о снижении их иммуноэкспрессии. Наблюдаемое несоответствие подчеркивает неоднозначность экспрессии различных подтипов PR и свидетельствует о нарушении их функциональности, даже при сохраненном количественном значении.
В проведенном нами исследовании было выявлено значимое повышение экспрессии ER и PR как в эпителии желез, так и в строме эндометрия при АМ. При этом количество пиноподий было значимо ниже, чем у здоровых женщин, что может свидетельствовать о дисрегуляции в передаче сигналов через PR. В строме ткани изменения носили менее выраженный и более вариабельный характер, что может быть обусловлено структурной устойчивостью стромальных элементов и их меньшей чувствительностью к гормональному воздействию.
Результаты настоящего исследования демонстрируют значительные изменения в экспрессии ER и PR в эндометрии пациенток с АМ, что согласуется с данными, представленными в современных научных работах. В нашем исследовании на фоне цитокинотерапии отмечено повышение не только количества прогестероновых рецепторов, но и их функциональности, проявляющееся ростом числа пиноподий.
A. Maclean et al. [11] предлагают пересмотреть упрощенное представление об АМ об как исключительно прогестеронорезистентном заболевании, так как в ряде случаев частично сохраняется чувствительность к прогестерону.
Заключение
Результаты исследования подчеркивают, что успешная тактика ведения пациенток с АМ должна учитывать не только клинические проявления заболевания, но и молекулярно-морфологические характеристики тканей, включая уровень экспрессии гормональных рецепторов и состояние клеточной активности. Выявленная гетерогенность ответа на применение цитокинотерапии свидетельствует о необходимости персонализированного подхода к выбору терапевтических схем, направленного на достижение наилучших морфофункциональных результатов.
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии Инсти-
тута хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290
Боровкова Екатерина Игоревна — д.м.н., доцент, профессор кафедры акушерства и гинекологии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-7140-262X
Белоусова Тамара Николаевна — к.м.н., главный врач ГБУЗ МО «ВПЦ»; 142700, Россия, г. Видное, ул. Заводская, д. 17; ORCID iD 0000-0003-3804-7691
Сафина Дарья Сергеевна — клинический ординатор кафедры акушерства и гинекологии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6598-9310
Контактная информация: Боровкова Екатерина Игоревна, e-mail: Katyanikitina@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.05.2025.
Поступила после рецензирования 24.06.2025.
Принята в печать 17.07.2025.
About the authors:
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0002-7830-2290
Ekaterina I. Borovkova — Dr. Sc. (Med.), Associate Professor, Professor of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-7140-262X
Tamara N. Belousova — C. Sc. (Med.), Chief Physician of Vidnoye Perinatal Center; 17, Zavodskaya str., Vidnoye, 142700, Russian Federation; ORCID iD 0000-0003-3804-7691
Dariya S. Safina — Clinical Resident of the Department of Obstetrics and Gynecology, Faculty of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-6598-9310
Contact information: Ekaterina I. Borovkova, e-mail: Katyanikitina@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 28.05.2025.
Revised 24.06.2025.
Accepted 17.07.2025.
1Клинические рекомендации. Женское бесплодие. 2021.