Введение
Ингибиторы дипептидилпептидазы 4 (иДПП-4) занимают важное место в современной терапии сахарного диабета 2 типа (СД2) благодаря их эффективности, положительному профилю безопасности и нейтральному влиянию на массу тела [1, 2]. В алгоритмах специализированной помощи больным СД подчеркивается, что раннее назначение иДПП-4 в комбинации с метформином способствует сохранению инсулин-секреторной функции поджелудочной железы [3]. Дополнительно, иДПП-4 актуальны для пациентов пожилого возраста, так как их прием ассоциирован с минимальным риском развития гипогликемий и возможен на всех стадиях хронической болезни почек. В Российской Федерации группа иДПП-4 представлена такими препаратами, как ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин, алоглиптин, гозоглиптин, гемиглиптин, эвоглиптин [3].
Костная ткань находится в процессе постоянного обновления за счет слаженной работы клеток костной ткани и гомеостаза микроэлементов, гормонов, факторов роста и цитокинов. В то же время в основе развития остеопороза лежит нарушение баланса костного ремоделирования вследствие влияния множества факторов (дефицит эстрогенов, нарушения в работе системы лиганд рецептора активатора ядерного фактора каппа В (RANKL) / рецептор активатор ядерного фактора каппа В (RANK) / остеопротегерин (OPG), угнетение дифференцировки мезенхимальных стволовых клеток, дисрегуляция остеогенных сигнальных путей). СД2 является значимым фактором риска ухудшения качества костной ткани, особенно у лиц пожилого возраста. Хроническая гипергликемия подавляет остеогенные сигнальные пути, индуцирует апоптоз остеоцитов и накопление конечных продуктов гликирования. В свою очередь, взаимодействие конечных продуктов гликирования со своими рецепторами угнетает остеогенез и стимулирует остеокластогенез. Таким образом, наличие СД2 ассоциировано с увеличением риска переломов на 22% [4]. Важно отметить, что лекарственная терапия также может влиять на костное ремоделирование, что подчеркивает необходимость изучения костных эффектов современных сахароснижающих препаратов, в том числе и иДПП-4.
Цель настоящего обзора — суммировать современные представления о влиянии иДПП-4 на параметры костного ремоделирования, показатели минеральной плотности кости (МПК) и риск переломов на основе экспериментальных и клинических исследований.
Патофизиологические предпосылки влияния иДПП-4 на кость
Механизм действия иДПП-4 основан на ингибировании фермента дипептидилпептидазы 4 (ДПП-4), что приводит к увеличению срока циркуляции эндогенного глюкагоноподобного пептида 1 (ГПП-1) [5].
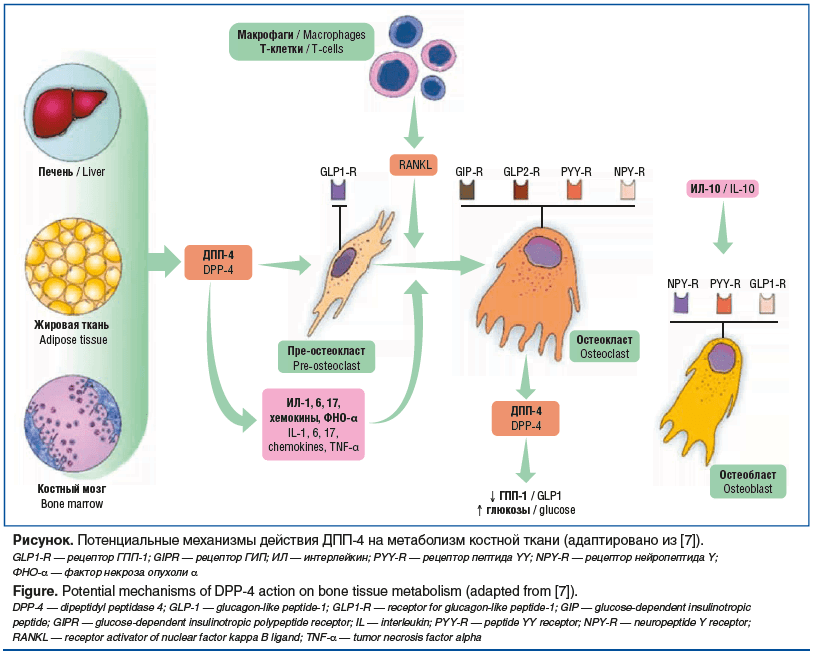
Теоретические предпосылки позитивного влияния препаратов группы иДПП-4 на костную ткань включают несколько механизмов. Во-первых, иДПП-4 предотвращают деградацию ГПП-1 и глюкозозависимого инсулинотропного пептида (ГИП), которые, в свою очередь, обладают положительными остеотропными эффектами [6]. Мезенхимальные клетки костного мозга, печени и жировой ткани продуцируют ДПП-4, в то время как RANKL индуцирует экспрессию ДПП-4 остеокластами, что приводит к снижению уровня ГПП-1 и повышению уровня глюкозы в крови. Кроме того, ДПП-4 расщепляет различные сайты на хемокинах, интерлейкинах и других цитокинах, активно участвующих в ремоделировании костной ткани. Потенциально ДПП-4 косвенно регулирует ремоделирование костной ткани, взаимодействуя с множеством пептидных субстратов на поверхности костных клеток, включая ГПП-1, ГПП-2, ГИП, нейропептид-Y и пептид YY [7] (см. рисунок).
![Рисунок. Потенциальные механизмы действия ДПП-4 на метаболизм костной ткани (адаптировано из [7]). GLP1-R — рецептор ГПП-1; GIPR — рецептор ГИП; ИЛ — интерлейкин; PYY-R — рецептор пептида YY; NPY-R — рецептор нейропептида Y; ФНО-α — фактор некроза опухоли Рисунок. Потенциальные механизмы действия ДПП-4 на метаболизм костной ткани (адаптировано из [7]). GLP1-R — рецептор ГПП-1; GIPR — рецептор ГИП; ИЛ — интерлейкин; PYY-R — рецептор пептида YY; NPY-R — рецептор нейропептида Y; ФНО-α — фактор некроза опухоли](https://www.rmj.ru/upload/medialibrary/0e1/ne5syr3bisvri7pnlh6qdeyxm9vr2zbl/758-1.png)
Дополнительно, ДПП-4 деактивирует стромальный фактор 1α (Stromal cell-derived factor 1α, SDF-1α), который экспрессируется в костной ткани зрелыми остеобластами, остеоцитами, клетками-предшественниками остеобластов и эндотелиальными клетками. Сигнальный путь SDF-1α / рецептор SDF-1α (CXCR4) играет ключевую роль в регуляции активности остеобластов, их пролиферации и экспрессии коллагена I типа [8].
Результаты in vitro и in vivo исследований о влиянии иДПП-4 на костную ткань неоднозначны. Например, обработка культуры стволовых клеток и остеобластов сакса-глиптином приводила к снижению экспрессии гена остеогенеза (Runx), а также к снижению выработки остеобластами остеокальцина, коллагена I типа и к снижению темпа минерализации [9]. В то же время в другом экспериментальном исследовании при лечении крыс ситаглиптином наблюдалась незначительная потеря МПК после овариэктомии и прирост МПК у животных без овариэктомии [10]. Кроме того, получены данные о снижении концентрации С-концевого телопептида (CTX, маркер костной резорбции) и улучшении структуры трабекулярной кости у крыс с СД при применении ситаглиптина [11].
В экспериментальном исследовании, выполненном в НМИЦ им. В.А. Алмазова, у самцов крыс моделировали СД2 при помощи стрептозотоцина и никотинамида с предварительным содержанием животных на высокожировом корме. Через 4 нед. после моделирования СД были сформированы группы: «СД» без лечения, «СД + СИТА» (лечение ситаглиптином 50 мг/кг в течение 8 нед.), «СД + КАНА» (лечение канаглифлозином 25 мг/кг в течение 8 нед.), «СД + ЭМПА» (лечение эмпаглифлозином 2 мг/кг в течение 8 нед.), также была сформирована контрольная группа. В конце эксперимента были измерены маркеры костного ремоделирования и кальций-фосфорного обмена (фактор роста фибробластов 23, остеокальцин, OPG, RANKL, кальций, фосфор), а также исследовали гистоархитектонику кости. В результате у животных, у которых в качестве сахароснижающей терапии был использован ситаглиптин, был выявлен более высокий уровень остеокальцина (маркер костеобразования). В то же время применение сита-глиптина не было ассоциировано со снижением площади костных трабекул, в отличие от ингибиторов натрий-глюкозного котранспортера 2-го типа (эмпаглифлозина и канаглифлозина), что свидетельствовало в пользу нейтрального или даже слабоположительного влияния ситаглиптина на костную ткань в эксперименте [12].
Таким образом, имеются некоторые экспериментальные данные о возможном позитивном влиянии иДПП-4 на костную ткань, что и было предпосылкой для изучения костных эффектов в клинических исследованиях.
Данные клинических исследований о влиянии иДПП-4 на костную ткань и риск переломов
Результаты клинических исследований, изучавших влияние иДПП-4 на параметры костного метаболизма, также неоднозначны, что может быть связано с различиями в дизайне исследований, популяциях пациентов и продолжительности наблюдения. Например, в исследовании M. Qiu et al. [13] сообщалось, что повышенная активность ДПП-4 в плазме ассоциирована с большей частотой остеопороза/остеопении у пациентов с впервые выявленным СД2. Хотя данная находка не имела прямой связи с применением иДПП-4, она указывала на потенциальную взаимо-связь между активностью ДПП-4 и здоровьем костной ткани при СД2. Повышенная активность ДПП-4 может быть индикатором патогенетических механизмов, влияющих на костный метаболизм, что требует дальнейшего изучения.
В другом исследовании продемонстрировано, что терапия различными препаратами из класса иДПП-4 может быть ассоциирована с увеличением уровня остеокальцина (что согласуется с описанными выше экспериментальными данными) [14]. В исследовании S. Hegazy et al. [15] были получены данные о снижении уровня щелочной фосфатазы в крови и диоксипиридолина в моче у женщин с СД2 на фоне приема ситаглиптина [15]. C другой стороны, M.C. Bunck et al. [16] отметили, что терапия вилдаглиптином в течение 1 года не приводила к статистически значимым изменениям уровня CTX, щелочной фосфатазы, кальция и фосфора по сравнению с исходным уровнем.
Метаанализ 28 рандомизированных клинических исследований [17] показал, что применение иДПП-4 снижает риск низкотравматичных переломов при СД (отношение шансов (ОШ) Мантеля — Хензеля 0,60, 95% доверительный интервал (ДИ) 0,37–0,99, р=0,045), даже после исключения сравнений с тиазолидиндионами или сульфонилмочевинами (ОШ 0,56, 95% ДИ 0,33–0,93, р=0,026). Дополнительно, в одном из обсервационных исследований продемонстрировано, что добавление иДПП-4 к метформину у больных СД2 позволяет снизить риск переломов по сравнению с монотерапией метформином (отношение рисков (ОР) 0,67, 95% ДИ 0,54–0,84) [14]. Это особенно важно, учитывая тот факт, что метформин является препаратом первой линии терапии СД2 и часто используется в комбинации с другими сахароснижающими препаратами.
В объединенном исследовании безопасности саксаглиптина в 20 РКИ с участием более 9000 больных СД2 частота переломов составила 1,1 на 100 человеко-лет и была несколько выше по сравнению с группой контроля (0,6) [18]. С другой стороны, в исследовании сердечно-сосудистой безопасности саксаглиптина, SAVOR-TIMI 53, прием препарата на протяжении двух лет не был связан с повышением риска переломов [19]. Однако другой метаанализ не выявил достоверных различий в риске низкотравматичных переломов между пациентами, получавшими иДПП-4, и контрольной группой (62 РКИ с участием 62 206 пациентов, включая 33 452 пациента на фоне приема иДПП-4; количество переломов в группе иДПП-4 — 364, в контрольной группе — 358 (ОР 0,95, 95% ДИ 0,83–1,10, р=0,5)) [20].
В исследовании сердечно-сосудистой безопасности ситалиптина (TECOS), включившем 14 671 больного СД2, не было выявлено статистически значимого увеличения риска переломов на фоне приема ситаглиптина по сравнению с плацебо (ОР 1,01, 95% ДИ 0,82–1,23, p=0,944). В целом за период наблюдения (в среднем 3 года) общая частота переломов составила 8,7 случая на 1000 человеко-лет. Что касается подгрупп переломов, то не было обнаружено существенных различий в частоте крупных остеопоротических переломов (p=0,673) или переломов бедренной кости (p=0,761). Следует подчеркнуть, что независимыми предикторами переломов оказались пожилой возраст, женский пол, европеоидная раса, низкое диастолическое артериальное давление и наличие диабетической нейропатии [21].
S. Oh et al. [22] проведен метаанализ влияния терапии на костный метаболизм у больных СД2. Первичной конечной точкой была вариабельность частоты переломов в зависимости от вида терапии, вторичной — различия в показателях МПК. В анализ включено 234 759 человек из 242 исследований. При проведении подгруппового анализа было продемонстрировано, что иДПП-4 значимо снижали риск невертебральных переломов, переломов позвонков и бедра, а также общий риск переломов (ОШ 0,34, 95% ДИ 0,25–0,45; ОШ 0,72, 95% ДИ 0,55–0,95; ОШ 0,67, 95% ДИ 0,55–0,82). Стоит отметить, что арГПП-1 также продемонстрировали значимое снижение риска всех переломов [22].
Согласно другому метаанализу применение алоглиптина было ассоциировано со снижением риска переломов по сравнению с плацебо (ОШ 0,51, 95% ДИ 0,29–0,88). Также продемонстрировано снижение риска переломов при применении алоглиптина в сравнении с линаглиптином (ОШ 0,45, 95% ДИ 0,20–0,99) и саксаглиптином (ОШ 0,46, 95% ДИ 0,25–0,84). При этом прием саксаглиптина был ассоциирован с более высоким риском переломов по сравнению с таковым на фоне приема ситаглиптина (ОШ 1,90, 95% ДИ 1,04–3,47) и препаратов сульфонилмочевины (ОШ 1,98, 95% ДИ 1,06–3,71) [23]. В метаанализе, изучающем риск влияния инкретинов на риск переломов, применение инкретинов не было ассоциировано с риском переломов (ОШ 0,97, 95% ДИ 0,88–1,08), но в подгрупповом анализе применение ситаглиптина 100 мг/сут (ОШ 0,495, 95% ДИ 0,3–0,8) или лираглутида 1,8 мг/сут (ОШ 0,621, 95% ДИ 0,4–0,9) снижало риск переломов [24].
Длительность СД2 и сахароснижающей терапии также может быть связана с изменением параметров костного ремоделирования и риском переломов. В частности, W.H. Hou et al. [25] подчеркнули тот факт, что при длительном (до 5 лет) применении иДПП-4 в качестве терапии второй линии у пациентов с СД2 наблюдается снижение риска переломов, включая переломы верхней конечности, по сравнению с пациентами, не получавшими иДПП-4. Дополнительно, B. Wang et al. [26] показали, что терапия иДПП-4 (ОР 0,93, 95% ДИ 0,88–0,98), так же как и метформином (ОР 0,88, 95% ДИ 0,85–0,92), ассоциирована со снижением риска переломов, в то время как использование инсулина (ОР 1,26, 95% ДИ 1,21–1,32), тиазолидиндионов (ОР 1,23, 95% ДИ 1,18–1,29) и меглитинидов (ОР 1,12, 95% ДИ 1,00–1,26), напротив, связано с повышением риска (p<0,05). Результаты когортного исследования [27], в дополнение к уже имеющимся данным, показали достоверно более низкий риск развития остеопороза у пациентов, получавших иДПП-4, по сравнению с контрольной группой (ОР 0,616, 95% ДИ 0,358–0,961, p=0,011), а анализ Каплана — Мейера продемонстрировал дозозависимый протективный эффект в отношении риска остеопороза (log-rank тест, p=0,039).
В то же время существуют и противоположные данные. Например, в исследовании J. Tamaki et al. [28] сообщается о повышении риска переломов бедра на фоне терапии иДПП-4, а также инсулином и ингибиторами α-глюкозидаз по сравнению с метформином. Следует отметить, что такие данные единичны и для подтверждения необходимы дополнительные исследования.
Важным независимым фактором риска остеопоротических переломов считаются падения. Так, исследователями отмечено достоверно меньшее число падений и переломов на фоне терапии линаглиптином по сравнению с глимепиридом (препарат сульфонилмочевины) [29], что может быть связано с меньшим риском гипогликемических событий. В противоположность этому, результаты другого исследования не выявили снижения риска низкотравматичных переломов при применении иДПП-4 по сравнению с препаратами сульфонилмочевины или инсулином, однако продемонстрировали более низкий риск, чем при терапии тиазолидиндионами [30].
Результаты некоторых исследований по оценке влияния иДПП-4 на риск переломов у больных СД2 суммированы в таблице.


Важно отметить, что в большинстве исследований не было выявлено значительных различий в риске переломов между различными представителями класса иДПП-4 (ситаглиптин, саксаглиптин, вилдаглиптин, линаглиптин и алоглиптин), что позволяет предположить у этой группы препаратов протективный класс-эффект в отношении костной ткани.
Одним из объяснений противоречивых данных о влиянии иДПП-4 на риск переломов может являться зависимость эффекта от продолжительности терапии. Так, в краткосрочных исследованиях (менее 1 года) не отмечено значительного влияния на риск переломов, в то время как длительная терапия не всегда ассоциирована с протективным влиянием иДПП-4 на костный обмен. Следует отметить, что риск переломов определяется не только состоянием костной ткани, но и другими факторами, такими как наличие хронических осложнений (диабетическая ретинопатии, нейропатии, нефропатия), мышечная слабость (саркопения), а также применение сахароснижающих препаратов, увеличивающих риск падений и переломов. В связи с этим при интерпретации данных о влиянии иДПП-4 на риск переломов необходимо учитывать эти потенциальные факторы.
С появлением в клинической практике качественных дженериков иДПП-4 терапия пациентов с СД2 препаратами из этой группы стала более доступной, а накопленные к настоящему времени данные о безопасности иДПП-4 в отношении костной ткани позволяют назначать их широкой популяции больных СД2.
Заключение
Таким образом, несмотря на противоречивость результатов некоторых исследований в отношении влиянии иДПП-4 на риск переломов, большинство полученных данных свидетельствуют о нейтральном или потенциально благоприятном эффекте этих препаратов на костную ткань. Важно отметить, что, в отличие от некоторых других классов сахароснижающих препаратов (например, тиазолидиндионов), иДПП-4 не ассоциированы с увеличением риска переломов, что является важным преимуществом при выборе терапии для пациентов с СД2 и высоким риском остео-поротических переломов.
Сведения об авторах:
Каронова Татьяна Леонидовна — д.м.н., главный научный сотрудник, руководитель НИЛ клинической эндокринологии, профессор кафедры эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0002-1547-0123
Тимкина Наталья Владимировна — к.м.н., врач-эндокринолог, младший научный сотрудник НИЛ клинической эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0001-9836-5427
Фукс Оксана Станиславовна — лаборант-исследователь НИЛ клинической эндокринологии ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0003-0112-5027
Аметов Александр Сергеевич — д.м.н., профессор, заслуженный деятель науки РФ, заведующий кафедрой эндокринологии, заведующий сетевой кафедрой ЮНЕСКО по теме «Биоэтика сахарного диабета как глобальная проблема» ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1; ORCID iD 0000-0002-7936-7619
Контактная информация: Каронова Татьяна Леонидовна, e-mail: karonova@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.08.2025.
Поступила после рецензирования 11.09.2025.
Принята в печать 30.09.2025.
About the authors:
Tatyana L. Karonova — Dr. Sc. (Med.), Chief Researcher, Head of the Research Laboratory of Clinical Endocrinology
Professor of the Department of Endocrinology; V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-1547-0123
Natalya V. Timkina — C. Sc. (Med.), endocrinologist, Junior Researcher of the Research Laboratory of Clinical Endocrinology, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0001-9836-5427
Oksana S. Fuks — Laboratory Researcher of the Research Laboratory of Clinical Endocrinology, V.A. Almazov National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0003-0112-5027
Alexander S. Ametov — Dr. Sc. (Med.), Professor, Honored Scientist of the Russian Federation, Head of the Department of Endocrinology, Head of the UNESCO Chair «Bioethics of Diabetes Mellitus as a Global Problem», Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-7936-7619
Contact information: Tatyana L. Karonova, e-mail: karonova@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 19.08.2025.
Revised 11.09.2025.
Accepted 30.09.2025.