Введение
Эндокринная офтальмопатия (ЭОП) характеризуется аутоиммунным воспалением и отеком орбитальных и периорбитальных тканей с дальнейшим формированием фиброза, часто возникающим на фоне дисфункции щитовидной железы с разными клиническими фенотипами [1, 2]. В основном заболевание развивается у пациентов с гипертиреозом, но может возникать также на фоне эутиреоза или гипотиреоза [1, 3]. В соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10), ЭОП кодируется как H06.2 (экзофтальм при нарушении функции щитовидной железы). Гистопатологические изменения ретробульбарных тканей при данном заболевании характеризуются лейкоцитарной инфильтрацией c накоплением интерстициальных гликозаминогликанов и развитием отека экстраокулярных мышц и соединительной ткани орбиты, а также адипогенезом, что приводит к расширению орбитального содержимого с последующим его фиброзированием [4].
Распространенность ЭОП в общей популяции составляет 0,54–0,9 случая на 100 000 в год у мужчин и 2,67–3,3 случая на 100 000 в год у женщин [1]. Нарушение зрения обусловлено развитием диплопии, компрессионно-ишемической оптической нейропатии, а также кератопатии. Даже когда зрительная функция сохранена, ЭОП может отрицательно влиять на качество жизни пациентов из-за наличия ретробульбарной боли или боли при движении глазных яблок, светобоязни, слезотечения и косметических изменений, включающих ретракцию века и/или проптоз [2].
К традиционным факторам риска ЭОП относятся курение, гиперхолестеринемия, дисфункция щитовидной железы, радиойодтерапия, высокий титр антител к рецепторам тиреотропина (thyrotropin receptor antibodies, TRAbs) и низкий титр антител к тиреопероксидазе (thyroid peroxidase antibodies, TPOAbs) и к тиреоглобулину (thyroglobulin antibodies, TgAbs) [5]. Новые факторы риска ЭОП включают высокий уровень тиреоглобулина (Thyroglobulin, Tg), дефицит селена, дисбаланс кишечной флоры c повышением количества Yersinia enterocolitica и Escherichia coli в пищеварительном тракте [6]. Воспалительная инфильтрация активированными лейкоцитами орбитальных тканей связана с перекрестным реагированием TRAbs на поверхности фибробластов орбиты и тимоцитов на фоне тиреоидной дисфункции. Орбитальные фибробласты служат ключевыми клетками-мишенями аутоиммунного ответа, опосредуемого рецепторами к тирео-тропному гормону (Thyrotropin receptor, TSHR) и инсулиноподобному фактору роста-1 (Insulin-like growth factor-1 receptor, IGF-1R). Повышенная продукция TRAbs связана с активностью и тяжестью ЭОП [4].
В настоящее время стандартное лечение ЭОП легкой степени включает контроль модифицируемых факторов риска прогрессирования данного заболевания, коррекцию тиреоидного статуса, а также симптоматическую терапию [7]. При активной фазе умеренной и тяжелой ЭОП назначается пульс-терапия глюкокортикоидами (ГК), которая имеет выраженное противовоспалительное и иммуносупрессивное действие за счет индукции апоптоза лимфоцитов, подавления их пролиферации и функциональной активности (включая продукцию антител В-клетками и цитокинов Т-клетками), дезактивации провоспалительных цитокинов и молекул адгезии с одновременным повышением уровня противовоспалительных цитокинов, а также ингибированием синтеза гликозаминогликанов. При наличии противопоказаний к проведению пульс-терапии ГК или при их неэффективности назначается орбитальная радиотерапия [1]. При тяжелой ЭОП помимо консервативного лечения часто применяют хирургические методы, включающие операции на веках и/или экстраокулярных мышцах, а также костную и/или жировую декомпрессию орбиты [8].
Стандартные методы лечения ЭОП (высокодозные ГК и орбитальная лучевая терапия) обладают существенными недостатками в виде высокой токсичности, ограниченной эффективности (особенно в отношении проптоза и диплопии), высокого риска рецидивов и наличия ряда противопоказаний [1, 7]. По этой причине необходим поиск и углубленное изучение профиля эффективности и безопасности, а также отдаленных результатов альтернативных методов лечения с использованием моноклональных антител, блокирующих ключевые звенья патогенеза заболевания.
Целью исследования является проведение сравнительного анализа публикаций, посвященных описанию патогенетических механизмов, эффективности, безопасности и отдаленных результатов таргетной терапии ЭОП моноклональными антителами.
Проведен систематический анализ современной литературы с использованием информационных баз PubMed, Scopus, MEDLINE, Cochrane Library и eLibrary за период с января 2005 г. по май 2025 г. Стратегия поиска включала комбинации ключевых слов: эндокринная офтальмопатия, патогенез, моноклональные антитела, таргетная терапия, тепротумумаб, ритуксимаб, тоцилизумаб, эффективность, безопасность. Первоначальный поиск дал 563 результата. Критерии включения: оригинальные исследования, посвященные таргетной терапии ЭОП моноклональными антителами и содержащие данные об их эффективности и/или безопасности, с доступным полным текстом. Критерии исключения: дублирующие публикации, работы, опубликованные ранее 2005 года.
Тепротумумаб
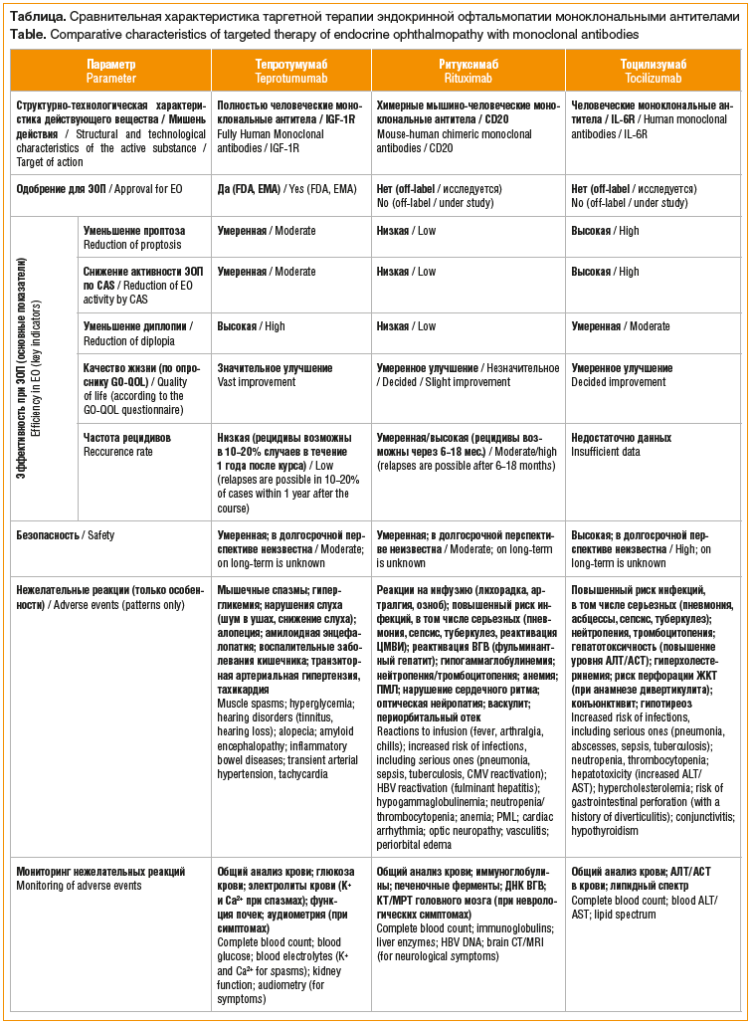
Тепротумумаб представляет собой рекомбинантные полностью человеческие моноклональные антитела, блокирующие IGF-1R [2, 9, 10]. У пациентов с ЭОП обнаружена сверхэкспрессия IGF-1R в орбитальных фибробластах, Т- и В-клетках. Аутоантитела к IGF-1R, перекрестно реагирующие с TSHR, активируют пролиферацию и дифференцировку орбитальных фибробластов (миофибробластов и адипоцитов), стимулируют высвобождение хемоаттрактантных цитокинов, что приводит к увеличению внеклеточного матрикса и адипогенезу в орбите [4, 11]. Тепро-тумумаб эффективно снижает экспрессию IGF-1R и TSHR фибробластами, блокируя каскад воспалительных реакций в орбите [5, 12].
В первом двойном слепом многоцентровом рандомизированном клиническом исследовании (РКИ), проведенном T.J. Smith et al. (2017), было включено 88 пациентов, из которых 76 (39 пациентов в группе плацебо и 37 — в группе тепротумумаба) завершили 24-недельную терапию, которая состояла из восьми внутривенных инфузий с 3-недельными интервалами (начальная доза составляла 10 мг/кг, затем увеличивалась до 20 мг/кг). Первичный положительный ответ определялся как снижение активности ЭОП на 2 балла или более по шкале клинической активности (Clinical activity score, CAS) и снижение на 2 мм или более проптоза. На 24-й неделе 69% пациентов, получавших тепротумумаб, и 20% пациентов, получавших плацебо, продемонстрировали первичный положительный ответ в отношении уменьшения экзофтальма и активности по CAS. Однако время до первого ответа было заметно короче в группе тепротумумаба, чем в группе плацебо (p<0,001). На фоне лечения также отмечалось улучшение показателей по опроснику качества жизни при ЭОП (GO-Quality-of-Life, GO-QOL) как по шкалам зрительного функционирования, так и по шкалам внешнего вида в сравнении с плацебо [13].
Следующее двойное слепое плацебо-контролируемое многоцентровое РКИ III фазы OPTIC, проведенное R.S. Douglas et al. (2020), включало 83 пациента (42 пациента в группе плацебо и 41 — в группе тепротумумаба). Первичный ответ на 24-й неделе лечения наблюдался у 83% пациентов, получающих тепротумумаб, в сравнении с 10% пациентов, получавших плацебо. Вторичные результаты (активность по CAS, оценка диплопии, качества жизни по опроснику GO-QOL) были значительно лучше в группе тепротумумаба, в сравнении с пациентами контрольной группы [14]. На основании результатов двух РКИ у пациентов с активной умеренной и тяжелой ЭОП Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) в январе 2020 г. одобрило тепротумумаб для лечения ЭОП в Соединенных Штатах Америки (США) [15]. Несмотря на убедительную доказательную базу, тепротумумаб пока не введен в клиническую практику в Российской Федерации (РФ) в связи с отсутствием государственной регистрации. Следует отметить, что стоимость курса тепротумумаба чрезвычайно высока и составляет порядка нескольких сотен тысяч долларов США. В марте 2022 г. тепротумумаб был одобрен Европейским агентством по лекарственным средствам (European Medicines Agency, EMA) [1].
Для оценки длительности терапевтического ответа G.J. Kahaly et al. [15] выполнили анализ данных двух ранее проведенных исследований с последующим наблюдением за пациентами в течение 72 нед. после лечения. Обнаружено, что экзофтальм рецидивировал у 33% пациентов, а диплопия — у 31%. В недавнем исследовании OPTIC-X пациенты, включенные в исследование OPTIC, не ответившие на лечение тепротумумабом или имеющие рецидив заболевания (37 пациентов в группе плацебо и 14 — в группе тепротумумаба), лечились или проходили повторное лечение, и в большинстве случаев был достигнут положительный ответ [16].
В двух ранее проведенных РКИ тепротумумаб был относительно безопасен, хотя сообщалось о нескольких нежелательных реакциях, включающих мышечные спазмы, диарею и гипергликемию [13, 14]. В пострегистрационный период были зарегистрированы единичные случаи развития сенсоневральной потери слуха, амилоидной энцефалопатии и язвенного колита [17–19]. На данный момент целесообразно использование тепротумумаба при лечении активной умеренной или тяжелой ЭОП в качестве первой линии терапии, где соотношение риска и пользы является оправданным [19].
Ритуксимаб
Ритуксимаб представляет собой синтетические химерные мышино-человеческие моноклональные антитела, нацеленные на антиген к кластеру дифференцировки 20 (Сluster of differentiation, CD20), экспрессируемый всеми субпопуляциями В-клеток [2]. Иммуносупрессивное действие ритуксимаба связано с истощением В-клеток путем прямого лизиса и, вероятно, влияет на их функцию презентации антигена и продукцию цитокинов [2, 20, 21]. Ритуксимаб, одобренный FDA для лечения ряда заболеваний (ревматоидный артрит, неходжкинская лимфома, гранулематоз Вегенера и хронический лимфоцитарный лейкоз), также исследуется при других аутоиммунных патологиях, включая ЭОП [21, 22].
Результаты исследований эффективности применения ритуксимаба при лечении ЭОП противоречивы. Одноцентровое двойное слепое РКИ, проведенное M.N. Stan et al. [23], включало 25 пациентов с активной фазой умеренной или тяжелой ЭОП (12 пациентов в группе плацебо и 13 — в группе ритуксимаба). Ритуксимаб вводился по две инфузии в дозе 1000 мг с интервалом в 2 нед. Первичным ответом на лечение было изменение CAS через 24 нед., а вторичным — изменения нескольких глазных параметров и качества жизни по опроснику GO-QOL. У пациентов, завершивших исследование (10 пациентов в группе плацебо и 11 — в группе ритуксимаба), не выявлено статистически значимых различий в результатах лечения между группами.
В одноцентровом РКИ, проведенном M. Salvi et al. [24], 32 пациента с ЭОП получали внутривенные инфузии ГК (суммарная доза 7,5 г) или ритуксимаба (две инфузии по 1000 мг с интервалом в 2 нед. для первых 12 пациентов, затем одна инфузия по 500 мг для последних четырех пациентов). Первичным результатом было снижение активности по CAS более и равное 2 баллам или инактивация заболевания (CAS менее 3 баллов). Через 24 нед. у 100% пациентов, получавших ритуксимаб, и у 69% пациентов, получавших ГК, отмечался положительный терапевтический эффект. При этом ни у одного пациента в группе ритуксимаба не обнаружено последующей реактивации ЭОП, которая наблюдалась у одной трети пациентов, получивших пульс-терапию ГК. В вышеуказанных исследованиях на фоне лечения ритуксимабом зафиксировано развитие оптической нейропатии у двух пациентов, васкулита — у одного пациента, тяжелого периорбитального отека и снижение зрения — у двух пациентов [23, 24].
В ретроспективном многоцентровом общенациональном исследовании J.B. Deltour et al. [25] подтвердили эффективность использования ритуксимаба в качестве препарата второй линии при лечении активной фазы ЭОП и непродолжительный анамнез заболевания. В метаанализе 12 исследований (152 пациента), проведенном J. Chen et al. [26], было показано, что применение ритуксимаба приводит к снижению титра TRAbs и активности ЭОП по CAS, но ограниченно эффективно при коррекции экзофтальма. Исследование I. Campi et al. [27], в которое вошли 40 пациентов с активной умеренной и тяжелой ЭОП, было направлено на определение оптимальной по эффективности и безопасности дозы ритуксимаба. На основании проведенного исследования показано, что оптимальной по соотношению стоимости лечения и профиля эффективности/безопасности является однократная схема приема 500 мг ритуксимаба. На данный момент ритуксимаб может рассматриваться в качестве терапии второй линии при активной умеренной или тяжелой ЭОП, однако с учетом противоречивых данных необходимо проведение крупных многоцентровых РКИ.
Тоцилизумаб
Механизм действия тоцилизумаба основан на ингибировании сигнального пути интерлейкина 6 за счет связывания с его растворимыми и мембранными рецепторами (Interleukin-6 receptor, IL-6R). Этот препарат, представляющий собой моноклональные антитела, имеет утвержденные показания: ревматоидный артрит, гигантоклеточный артериит, ювенильный идиопатический артрит [22]. Интерлейкин 6 является мощным провоспалительным цитокином, экспрессируемым Т-клетками и макрофагами, необходимым для поддержания аутоиммунного воспаления в орбите. Обнаружена его сверхэкспрессия фибробластами орбиты и способность стимулировать экспрессию TSHR и гликоаминогликанов при ЭОП [28]. Дополнительным преимуществом тоцилизумаба является возможность его подкожного введения [29].
Плацебо-контролируемое РКИ, проведенное J.V. Perez-Moreiras et al. [30], включало 32 пациента с ЭОП, имеющих резистентность к ГК, которые получали тоцилизумаб внутривенно (8 мг/кг массы тела, 4 дозы с интервалом в 4 нед.) либо плацебо. Снижение активности ЭОП у пациентов обеих групп не позволяет однозначно судить о причине улучшения: оно могло быть следствием отсроченного действия ГК или естественной ремиссии заболевания. Тоцилизумаб продемонстрировал ограниченную эффективность в уменьшении экзофтальма и диплопии. Препарат характеризовался хорошей переносимостью, однако наблюдались нежелательные явления, включая гиперхолестеринемию, нейтропению, умеренное повышение уровня трансаминаз, инфекционные осложнения и головную боль.
Национальное открытое многоцентровое обсервационное исследование, проведенное L. Sánchez-Bilbao et al. [31], включало 48 пациентов с ЭОП, рефрактерной к традиционной терапии ГК, которым назначался тоцилизумаб. На фоне лечения отмечались значительное улучшение максимально корригированной остроты зрения, снижение активности ЭОП по CAS и нормализация внутриглазного давления через 1 мес., а достигнутые результаты сохранялись в течение 1 года. В ходе данного исследования серьезных побочных эффектов не наблюдалось. Ряд небольших неконтролируемых и ретроспективных исследований подтверждает способность тоцилизумаба снижать активность заболевания, уменьшать экзофтальм и диплопию, а также улучшать показатели качества жизни по шкале GO-QOL [32–34]. В обсервационном исследовании G. Boutzios et al. [35] с участием 12 пациентов с активной ЭОП, рефрактерной к внутривенным ГК (первая линия: метилпреднизолон, кумулятивная доза 4,5 г за 12 нед.), лечение тоцилизумабом (8 мг/кг в/в инфузии каждые 28 дней, 4 мес.) привело к инактивации заболевания (CAS <3) и уменьшению экзофтальма у всех пациентов, а также к устранению диплопии у 25% пациентов через 6 нед. после курса. Положительная динамика по данным рентгенологического исследования после терапии тоцилизумабом отмечена у 75% пациентов, тогда как у 16,7% зафиксировано отсутствие ответа, а у 8,3% — прогрессирование заболевания.
Согласно метаанализу, поведенному A.F. Duarte et al. [36], включающему 29 исследований, показано, что тоцилизумаб использовали в основном при резистентных к пульс-терапии ГК формах или при рецидивах заболевания, с дозировкой от 4 до 8 мг/кг каждые 4 нед. при внутривенном введении или еженедельной подкожной дозе 162 мг. Продолжительность лечения обычно корректировалось в зависимости от клинического ответа. При этом серьезных нежелательных реакций во время лечения тоцилизумабом не было зарегистрировано. Было показано, что тоцилизумаб можно применять в терапии второй линии при активной умеренной или тяжелой ЭОП, особенно в случае рефрактерных к ГК формах заболевания. В настоящее время проводится многоцентровое РКИ IIb фазы (NCT04876534), в котором сравнивается эффективность лечения пациентов с ЭОП тоцилизумабом в качестве препарата первой линии с группой пациентов, получающих метилпреднизолон [37].
Согласно метаанализу Y. Hu et al. [38] (12 исследований, 448 пациентов) применение тоцилизумаба показало более значимые результаты по противовоспалительному эффекту, снижению TRAbs и экзофтальма, наряду с лучшим профилем безопасности, а терапия тепротумумабом выявила наибольшую эффективность в отношении диплопии. Тоцилизумаб имеет самый высокий профиль безопасности, за ним следуют ритуксимаб и тепротумумаб. Наиболее частыми нежелательными реакциями после применения тоцилизумаба были гематологические и метаболические нарушения, ритуксимаба — реакции, связанные с инфузией, а тепротумумаба — гипергликемия и ототоксичность. Прямых рандомизированных исследований, направленных на сравнение эффективности и безопасности данных препаратов при лечении ЭОП, не проводилось [22]. Исследования отличаются по дизайну (РКИ, когортные), критериям включения (активность, тяжесть, рефрактерность), используемым дозам и схемам, длительности наблюдения, что затрудняет прямое сравнение. Профили безопасности хорошо известны для их основных показаний (ревматология, онкология), но специфические риски при ЭОП требуют дальнейшего изучения. При выборе препарата важна оценка коморбидности пациента и индивидуальных факторов риска. В таблице представлена сравнительная характеристика таргетной терапии моноклональными антителами ЭОП, основанная на имеющихся исследованиях [1, 2, 22, 39].
Альтернативные моноклональные антитела
Линситиниб (не имеет регистрационного удостоверения в РФ) является пероральным ингибитором киназы малых молекул IGF-1R и инсулинового рецептора. Подавляя пути PI3K/Akt и внеклеточную сигнально-регулируемую киназу (Extracellular signal-regulated kinase, ERK), линситиниб ингибирует вызванную IGF-1 клеточную пролиферацию и секрецию гликозаминогликанов орбитальными фибробластами [40]. В настоящее время проводится многоцентровое двойное слепое плацебо-контролируемое РКИ IIb/III фазы (NCT06112340), в котором оценивается эффективность и безопасность линситиниба у 90 пациентов с активной умеренной или тяжелой ЭОП. Согласно промежуточным данным исследования у пациентов, получавших линситиниб в дозе 150 мг дважды в сутки, отмечено уменьшение экзофтальма на 52% от исходного уровня к 24-й неделе терапии, что достоверно превышало результаты в группе плацебо (p=0,01). Не зарегистрировано нарушений слуха, связанных с приемом препарата, а гипергликемия развилась у 1 из 29 пациентов и не требовала специальной коррекции [39]. Удобство пероральной формы в сочетании с высокой клинической эффективностью и оптимальным профилем безопасности делает линситиниб перспективным препаратом для лечения пациентов с ЭОП.
Белимумаб представляет собой полностью человеческие моноклональные антитела класса IgG1, направленные против фактора стимуляции цитокинов В-клеток (B-cell stimulating factor, BSF или B-cell activating factor, BAFF). Данный препарат одобрен для пациентов с системной красной волчанкой [41]. Обнаружено, что BAFF экспрессируется на злокачественных В-клетках, моноцитах, дендритных клетках, нейтрофилах и стромальных лимфоидных клетках. В-клетки проходят процесс созревания от стволовых клеток до зрелых В-клеток и В-клеток памяти, из которых в дальнейшем образуются плазматические клетки [42]. Антиген CD20, который является терапевтической мишенью для ретуксимаба, экспрессируется всеми фенотипами В-клеток за исключением плазматических клеток. В процессе созревания В-клеток взаимодействие с рецептором фактора, активирующего B клетки (B-cell activating factor receptor, BAFF-R), вызывает ускорение их созревания в плазматические клетки с индукцией синтеза антител [42, 43].


В исследовании G. Vannucchi et al. [44] показан повышенный сывороточный уровень BAFF у пациентов с ЭОП, независимо от активности заболевания, по сравнению с контролем (p<0,001). В ходе исследования обнаружены корреляции между уровнем BAFF и титром антител к Tg в сыворотке крови. После лечения ритуксимабом наблюдалось компенсаторное увеличение концентраций BAFF. На фоне пульс-терапии ГК отмечалось значительное снижение содержания BAFF (p<0,01). Учитывая, что патогенетической основой ЭОП является аутоиммунное воспаление, управляемое B-клетками, проведение дальнейших исследований по эффективности и безопасности лечения ЭОП белимумабом является перспективным [42, 45].
Батоклимаб (не имеет регистрационного удостоверения в РФ) является ингибитором неонатального фрагмента кристаллизующегося рецептора (Neonatal fragment crystallizable receptor, FcRn), который снижает рециркуляцию IgG и может способствовать деградации антител против TSHR и IGF-1R. Его эффективность была оценена в двойном слепом РКИ, проведенном G.J. Kahaly et al. [46], с участием 77 пациентов с умеренной и тяжелой ЭОП. Испытуемые получали еженедельные подкожные инъекции батоклимаба (680 мг, 340 мг или 255 мг) или плацебо. Через 12 нед. группа, принимающая батоклимаб (680 мг), показала значительное уменьшение титра TRAbs.
Фактор некроза опухоли α (tumor necrosis factor α, TNF-α) — цитокин, который оказывает плейотропное действие на различные типы клеток и является основным регулятором воспалительных реакций, в том числе аутоиммунных. Данный цитокин вырабатывается Т-лимфоцитами, макрофагами и естественными клетками-киллерами и существует в растворимой и трансмембранной форме с гомотримерной белковой структурой, состоящей из 157 аминокислот [47]. При ЭОП TNF-α участвует в воспалении и ремоделировании орбитальных тканей за счет усиления экспрессии молекул межклеточной адгезии-1 (inter-cellular adhesion molecule-1, ICAM-1) в орбитальных фибробластах, увеличения синтеза гликозаминогликанов, при этом он оказывает ингибирующее влияние на орбитальный адипогенез [45, 48]. Ключевые ингибиторы TNF-α включают инфликсимаб (рекомбинантное химерное моноклональное антитело) и адалимумаб (человеческое моноклональное антитело IgG1) [45]. В результате однократного введения инфликсимаба продемонстрированы положительные терапевтические эффекты у пациентов с ЭОП, которые имели значительное уменьшение активности заболевания по CAS, улучшение зрительных функций и отсутствие краткосрочных нежелательных реакций [48]. Ретроспективное исследование, проведенное R. Ayabe et al. [49] на 10 пациентах с ЭОП, получавших лечение адалимумабом в течение 12 нед., выявило снижение клинических симптомов и активности заболевания по CAS у 6 пациентов. Для более детальной оценки эффективности и безопасности лечения ЭОП ингибиторами TNF-α необходимо проведение крупных РКИ.
Сатрализумаб — гуманизированное моноклональное антитело к IL-6R, разработанное компаниями Chugai Pharmaceutical и Roche. В 2020 г. на основании двух РКИ III фазы подкожный сатрализумаб получил одобрение в Канаде для лечения заболеваний спектра оптиконевромиелита у взрослых и детей в возрасте старше 12 лет, имеющих серопозитивную реакцию на аутоантитела к водным каналам аквапорина 4 (AQP4-IgG). Впоследствии сатрализумаб был одобрен в Японии, Швейцарии и США. Согласно клиническому наблюдению T. Tokuhisa et al. [50] терапия данным препаратом продемонстрировала клиническую эффективность в отношении AQP4-IgG-положительной компрессионно-ишемической оптической нейропатии при стероидрезистентной форме эндокринной офтальмопатии. В настоящее время проводится многоцентровое РКИ (NCT06106828) по оценке эффективности и безопасности применения сатрализумаба для лечения ЭОП.
Дополнительные иммуномодулирующие агенты, изучаемые для потенциального использования при лечении ЭОП, включают: секукинумаб — моноклональные антитела к IL-17А (NCT04737330), афлиберцепт — рекомбинантный химерный белок-ловушку, связывающий сосудистый эндотелиальный фактор роста (vascular endothelial growth factor, VEGF) A и B и плацентарный фактор роста (placental growth factor, PlGF), а также не зарегистрированные на территории РФ искалимаб — моноклональные антитела к CD40 и K1-70 — моноклональные антитела к TSHR (NCT02904330) [37, 39].
Заключение
Тепротумумаб в настоящее время обладает наиболее убедительной доказательной базой по эффективности (особенно в отношении диплопии) и приемлемому профилю безопасности при ЭОП, что подтверждено в крупных РКИ и привело к его одобрению в качестве первой линии терапии. Однако на момент подготовки настоящего обзора тепротумумаб не имеет регистрационного удостоверения Министерства здравоохранения РФ. Ритуксимаб показал противоречивые результаты, и его применение сейчас ограничено. Тоцилизумаб демонстрирует обнадеживающие результаты по клинической эффективности (инактивация активности, уменьшение проптоза) и безопасности, особенно у пациентов с рефрактерными к ГК формами ЭОП, но требует подтверждения в крупных РКИ и пока не одобрен в качестве препарата первой линии терапии. Другие таргетные препараты (белимумаб, инфликсимаб, адалимумаб, секукинумаб, афлиберцепт и др.) находятся на стадии активного изучения.
Таким образом, появление таргетной терапии моноклональными антителами ЭОП знаменует переход на качественно новый уровень в лечении данного заболевания от неспецифической иммуносупрессии ГК, имеющей ряд нежелательных реакций, к патогенетически обоснованному воздействию на молекулярные механизмы, запускающие и поддерживающие воспаление и ремоделирование тканей орбиты. Хотя вопросы доступности и долгосрочного прогноза остаются актуальными для изучения, тем не менее данное направление в терапии открыло новую эру в персонализированном ведении пациентов с ЭОП с учетом специфических аутоиммунных механизмов данной патологии. Необходимо проведение мультицентровых РКИ, направленных на определение оптимального режима введения, а также на сравнение профиля эффективности и безопасности различных препаратов таргетной терапии ЭОП.
Сведения об авторах:
Атарщиков Дмитрий Сергеевич — к.м.н., ассистент кафедры офтальмологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4401-9099
Таскина Елизавета Сергеевна — к.м.н., доцент кафедры офтальмологии ФГБОУ ВО ЧГМА Минздрава России; 672000, Россия, г. Чита, ул. Горького, д. 39а; ORCID iD 0000-0002-6223-8888
Контактная информация: Таскина Елизавета Сергеевна, e-mail: taskins@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.06.2025.
Поступила после рецензирования 04.07.2025.
Принята в печать 29.07.2025.
About the authors:
Dmitry S. Atarshchikov — C. Sc. (Med.), Assistant Professor of the Department of Ophthalmology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-4401-9099
Elizaveta S. Taskina — C. Sc. (Med.), Associate Professor of the Department of Ophthalmology, Chita State Medical University; 39a Gorky str., Chita, 672000, Russian Federation; ORCID iD 0000-0002-6223-8888
Contact information: Elizaveta S. Taskina, e-mail: taskins@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.06.2025.
Revised 04.07.2025.
Accepted 29.07.2025.