Введение
Ишемический инсульт (ИИ) остается одной из ведущих причин смертности и инвалидизации в мире, несмотря на совершенствование первичной профилактики и оказания специализированной помощи1 [1]. Особенно тревожным является высокий риск повторных сосудистых событий в течение первого года после ИИ, достигающий, по данным ряда когортных исследований, 10–15% [2]. Это актуализирует необходимость эффективной вторичной профилактики, важнейшим компонентом которой является гиполипидемическая терапия.
Современные клинические рекомендации, в том числе российские (ред. 2024 г.), подчеркивают обязательность интенсивного снижения уровня липопротеинов низкой плотности (ЛПНП) у пациентов, перенесших ИИ или транзиторную ишемическую атаку (ТИА). Целевой уровень ЛПНП при очень высоком сосудистом риске установлен на уровне <1,4 ммоль/л2 [3]. Для достижения этой цели рекомендуется назначение высокоинтенсивных доз статинов (аторвастатин 40–80 мг, розувастатин 20–40 мг). При недостаточной эффективности монотерапии показано добавление ингибитора всасывания холестерина — эзетимиба 10 мг/сут как второй линии терапии. У отдельных пациентов также может рассматриваться применение PCSK9-таргетной терапии [3, 4]. Среди них инклисиран (Сибрава) представляет собой инновационный препарат малой интерферирующей РНК (миРНК) с доказанной способностью снижать уровень ЛПНП более чем на 50% и удобным режимом введения (дважды в год после загрузочной схемы). Его применение может рассматриваться у пациентов с очень высоким сосудистым риском, у которых целевые уровни ЛПНП не достигаются на фоне максимально переносимых доз статинов с эзетимибом.
Тем не менее, несмотря на доказанную эффективность гиполипидемической терапии, приверженность лечению остается недостаточной. По данным исследований, проведенных в США, менее 50% пациентов продолжают прием статинов через 6 мес. после инсульта, а спустя год этот показатель снижается до 30–40% [5]. В Европе уровень приверженности колеблется от 35 до 60% в зависимости от страны и социально-экономических условий [6]. В России ситуация схожая: в исследованиях последних лет приверженность гиполипидемической терапии у пациентов после инсульта не превышала 45% (в одноцентровом когортном исследовании — 22% полностью приверженных) [7], а достижение целевых уровней ЛПНП фиксировалось лишь у 10–15% больных [8].
Интересные результаты были получены в исследованиях, посвященных оценке приверженности препаратам при назначении комбинированной терапии. Так, в итальянском когортном исследовании, проведенном L. Perez de Isla et al. [9], было показано, что приверженность фиксированной комбинации, представляющей собой единый препарат, содержащий сразу два действующих вещества, статин + эзетимиб, достигала 75,2%, тогда как при приеме тех же препаратов в виде свободной комбинации (раздельный прием каждого компонента) — лишь 51,8%. Эти данные подтверждаются и другими исследованиями, включая европейские регистры, в которых фиксированные формы эзетимиба и статинов ассоциировались с большей устойчивостью терапии и более частым достижением целевых уровней липидов [10, 11].
Отдельного внимания заслуживают исследования, в которых выполнялся анализ приверженности терапии ингибиторами PCSK9. В швейцарском наблюдательном исследовании ECARA, проведенном в 2017–2019 гг., было показано, что 89% пациентов с высоким сердечно-сосудистым риском, получавших эволокумаб, сохраняли полную приверженность терапии в течение 12 мес. При этом достижение целевых уровней ЛПНП (<1,4 ммоль/л) отмечалось чаще у тех, кто получал не только монотерапию эволокумабом, но и комбинированное лечение — с эзетимибом или статинами [12].
Аналогичные результаты были получены в исследовании X. Ye et al. [13], где приверженность терапии ингибиторами PCSK9 оставалась высокой на протяжении 1–2 лет, достигая 92–98%. При этом есть работы, в которых установлено снижение приверженности ингибиторам PCSK9 со временем. Например, в одном из обзоров было отмечено, что только около 30–40% пациентов сохраняют высокую приверженность терапии ингибиторами PCSK9 через 1–2 года после начала лечения [14]. Факторами, влияющими на снижение приверженности, могут быть высокая стоимость препаратов, необходимость регулярных инъекций и ограниченный доступ к терапии. Следовательно, несмотря на высокую эффективность ингибиторов PCSK9 в снижении уровня ЛПНП и профилактике сердечно-сосудистых событий, обеспечение долгосрочной приверженности терапии остается актуальной задачей. Необходимы стратегии, направленные на повышение доступности и удобства применения этих препаратов, а также на информирование пациентов о важности соблюдения режима лечения.
Анализ региональных данных, в том числе по Республике Татарстан, подтверждает эту тенденцию. Несмотря на наличие медицинских показаний (включая дислипидемию и стенозы магистральных артерий головы и шеи) и назначение врачами статинов, большая часть пациентов либо не получают терапию, либо принимают препараты нерегулярно.
Таким образом, несмотря на очевидную клиническую значимость гиполипидемической терапии и ее доказанную эффективность в профилактике повторных сосудистых событий, реальные показатели ее адекватного применения пациентами остаются низкими. В этой связи представляется актуальным изучение не только объективной медицинской потребности в данной терапии у пациентов, перенесших ИИ, но и факторов, определяющих степень приверженности пациентов назначенному лечению.
Целью исследования стало изучение показателей липидного спектра крови и степени атеросклеротического поражения магистральных сосудов головного мозга у пациентов с первичными и повторными ИИ и ТИА, а также приверженности назначенной гиполипидемической терапии и выявление социально-демографических, клинических и психологических факторов, влияющих на соблюдение рекомендаций приема статинов в условиях реальной клинической практики.
Материал и методы
В исследование включен 1971 пациент, перенесший ИИ или ТИА, находившийся на стационарном лечении в неврологическом отделении для больных с острыми нарушениями мозгового кровообращения (ОНМК) ГАУЗ «ГКБ № 7 им. М.Н. Садыкова» (Казань) в период с 2021 по 2022 г.
Критерии включения: пациенты, госпитализированные с диагнозом «ишемический инсульт» или «транзиторная ишемическая атака» (по МКБ-10: I63, G45); возраст ≥18 лет; наличие верифицированного диагноза, подтвержденного клинико-инструментальными методами (компьютерная томография (КТ), магнитно-резонансная томография (МРТ) головного мозга), при ТИА — неврологическая симптоматика с регрессом в течение 24 ч без очагов острого инфаркта головного мозга; согласие пациента (или законного представителя) на обработку медицинской информации.
Критерии невключения: геморрагический инсульт, субарахноидальное кровоизлияние; ИИ вследствие травмы, опухоли, инфекционного процесса или других причин, не требующих применения в качестве вторичной профилактики гиполипидемической терапии; возраст <18 лет.
Критерии исключения: отказ пациента или его законного представителя от участия в исследовании; смерть в первые сутки госпитализации до проведения необходимых обследований; выявление у пациента других состояний, существенно искажающих оценку липидного обмена (например, острый сепсис, терминальная стадия онкологического процесса).
Из общего числа включенных пациентов мужчин было 924 (46,8%), женщин — 1047 (53,2%).
Диагноз ОНМК верифицировался на основании клинической симптоматики и данных нейровизуализации, включая рентгеновскую КТ и МРТ головного мозга. Патогенетическая классификация ИИ осуществлялась в соответствии с международной классификацией Trial of Org 10172 in Acute Stroke Treatment (TOAST). Тяжесть инсульта оценивалась с использованием шкалы инсульта Национального института здоровья США (The National Institutes of Health Stroke Scale, NIHSS) при поступлении в стационар, через сутки после поступления и при выписке. Дополнительно проводилась оценка когнитивных функций по Монреальской когнитивной шкале (Montreal Cognitive Assessment, MoCA) и уровня тревожности и депрессии по госпитальной шкале тревожности и депрессии (Hospital Anxiety and Depression Scale, HADS). У пациентов с ТИА риск повторных событий оценивался по шкале ABCD2, а у перенесших ИИ — по шкале Essen Stroke Risk Score (ESRS). Все обследования выполнялись в остром периоде инсульта, после перевода пациента из отделения реанимации в неврологическое отделение, при стабилизации состояния.
Нормальность распределения количественных переменных проверяли критерием Шапиро — Уилка. Данные представляли как среднее ± стандартное отклонение (M±SD) при нормальном распределении или как медиану и квартили (Me [Q1; Q3]) при распределении, не соответствовавшем нормальному. Категориальные переменные сравнивали с применением критерия χ2 Пирсона; при ожидаемых частотах <5 применяли точный критерий Фишера. Для сравнения долей приверженности между двумя группами (например, «проживает один / в семье», «село/город», «MoCA нарушена/норма») использовали двусторонний χ2-тест; при необходимости оценивали линейный тренд критерием Кокрана — Армитеджа. Уровень статистической значимости устанавливали как двусторонний при p<0,05.
Результаты и обсуждение
Из общего числа включенных в исследование пациентов (n=1971) ИИ диагностирован в 1609 (81,6%) наблюдениях, ТИА — в 362 (18,4%). Распределение пациентов по патогенетическим подтипам инсульта было следующим:
-
атеротромботический инсульт — 645 пациентов (32,7% от общей выборки, 40,1% от всех ИИ);
-
кардиоэмболический инсульт — 532 пациента (27,0% от общей выборки, 33,1% от всех ИИ);
-
лакунарный инсульт — 284 пациента (14,4% от общей выборки, 17,6% от всех ИИ);
-
инсульт другой уточненной этиологии — 16 пациентов (0,8% от общей выборки, 1,0% от всех ИИ);
-
инсульт неуточненной этиологии — 104 пациента (5,4% от общей выборки, 6,5% от всех ИИ);
-
ESUS (инсульт с неустановленным источником эмболии) — 28 пациентов (1,4% от общей выборки, 1,7% от всех ИИ).
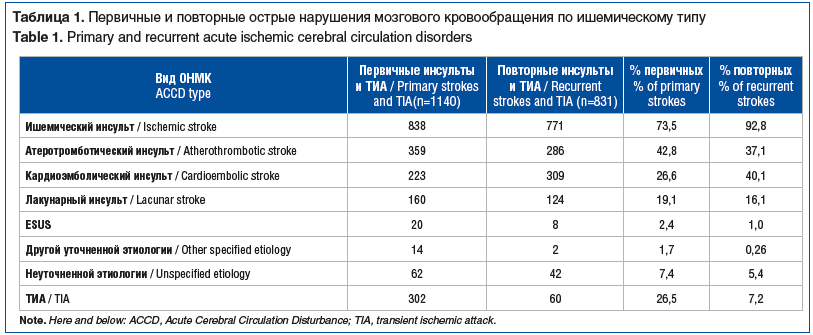
У 1140 пациентов ОНМК развилось впервые, в 831 наблюдении были повторные острые церебральные ишемические события. Распределение пациентов по патогенетическим подтипам инсульта и ТИА представлено в таблице 1. Наибольшая доля среди повторных инсультов приходилась на атеротромботический и кардиоэмболический подтипы.

В проведенном нами исследовании оценивалась распространенность нарушений липидного спектра у пациентов с ИИ (первичный и повторный инсульт) в зависимости от его патогенетического подтипа. Особое внимание уделялось трем ключевым компонентам липидного обмена: повышенному уровню ЛПНП, повышенному уровню триглицеридов (ТГ) и снижению уровня липопротеинов высокой плотности (ЛПВП).
У пациентов с первичным ИИ средний уровень ЛПНП составил 6,1±1,8 ммоль/л, что существенно превышает пороговое значение <1,8 ммоль/л, рекомендованное для лиц с высоким сосудистым риском, и тем более <1,4 ммоль/л для пациентов с очень высоким риском. Концентрация ТГ в этой группе составила в среднем 2,3±0,9 ммоль/л (при норме <1,7 ммоль/л), а ЛПВП — около 1,1±0,3 ммоль/л, что находится на нижней границе нормы. Это свидетельствует о преобладании атерогенных липидных фракций, способствующих прогрессированию атеросклероза.
У больных с повторным ИИ, среди которых почти половина (43,7%) получала гиполипидемическую терапию, отмечались более низкие, чем у пациентов с первичным инсультом, но превышающие норму показатели. Средняя концентрация ЛПНП составила 5,8 ммоль/л, ТГ — 2,1 ммоль/л, ЛПВП — 1,1 ммоль/л. Эти данные свидетельствуют о частичном восстановлении липидного обмена у получавших лечение, но при этом подчеркивают, что терапевтический контроль остается недостаточным, особенно в условиях неполной приверженности или неадекватной титрации доз препаратов.
При анализе показателей липидного спектра крови у всех обследованных пациентов в зависимости от патогенетического подтипа инсульта выявлены следующие особенности. У пациентов с атеротромботическим инсультом как при первичном, так и при повторном эпизоде наблюдались наиболее высокие средние уровни ЛПНП — 6,2±1,0 ммоль/л при первичном инсульте и 5,9±0,9 ммоль/л — при повторном; концентрация ТГ — 2,5 [2,0; 3,0] и 2,3 [1,9; 2,8] ммоль/л соответственно. Уровень ЛПВП оставался сниженным (1,02±0,25 и 1,00±0,22 ммоль/л). В подгруппе кардиоэмболического инсульта уровни ЛПНП также превышали целевые и составили 6,0±0,9 и 5,7±0,8 ммоль/л, ТГ — 2,4 [1,9; 2,9] и 2,1 [1,7; 2,6] ммоль/л, ЛПВП — 1,02±0,20 и 1,00±0,21 ммоль/л. При лакунарных инфарктах показатели были несколько ниже: ЛПНП 5,9±0,8 и 5,6±0,7 ммоль/л, ТГ 2,2 [1,8; 2,6] и 2,0 [1,6; 2,4] ммоль/л, ЛПВП 0,95±0,20 и 0,91±0,18 ммоль/л. В группе инсультов вследствие редких причин (ESUS и уточненные формы) медианные значения ЛПНП составили 5,8 [5,7; 5,9] и 5,3 [5,2; 5,4] ммоль/л, ТГ — 2,5 [2,3; 2,6] ммоль/л, ЛПВП — 1,0 [0,95; 1,05] ммоль/л. При инсультах неуточненной этиологии сохранялась выраженная дислипидемия: ЛПНП 5,8±0,7 ммоль/л, ТГ 2,6 [2,2; 3,0] ммоль/л, ЛПВП 0,98±0,19 ммоль/л.
Следовательно, даже несмотря на наличие гиполипидемической терапии, большинство пациентов как с первичным, так и с повторным ИИ остаются вне зоны терапевтических целей (см. рисунок).

Анализ показателей липидного обмена у пациентов с ИИ и ТИА выявил высокий уровень дислипидемии в обеих подгруппах — как при первичных, так и при повторных острых цереброваскулярных событиях. Особенно выраженным было превышение целевых значений ЛПНП, что подчеркивает актуальность гиполипидемической терапии как одного из ключевых инструментов вторичной профилактики.
Гиперлипидемия ассоциирована с атеросклерозом магистральных сосудов головного мозга. В связи с этим был проведен анализ степени выраженности стенозирующего процесса как одного из важнейших факторов риска как первичного, так и повторного инсульта. Оценка степени стеноза магистральных артерий головы и шеи проводилась с использованием ультразвуковых методов (дуплексное и триплексное сканирование экстра- и интракраниальных артерий), а также по данным магнитно-резонансной ангиографии и мультиспиральной компьютерной томографической ангиографии.
При госпитализации в стационар у 95% всех обследованных пациентов с помощью методов визуализации выявлены разной степени стенозы сосудов головы и шеи.
Среди пациентов с первичным ИИ и ТИА (n=1140) распределение степеней стеноза в «причинной» артерии выглядело следующим образом: стенозы <50% были зафиксированы в 29% случаев, стенозы 50–69% — в 31%, а критические стенозы ≥70% — в 40%.
У пациентов с повторными ИИ и ТИА (n=831) распределение степеней стеноза также свидетельствовало о значительной выраженности атеросклеротического процесса: стенозы <50% регистрировались в 30% случаев, 50–69% — в 35%, а ≥70% — в 35%.
Соответственно, более чем у четверти больных с ИИ, вне зависимости от его рецидивности, обнаруживаются значимые поражения магистральных артерий головы, требующие комплексного подхода к диагностике, лечению и последующему наблюдению.
Учитывая высокую распространенность гемодинамически значимых стенозов в сочетании с дислипидемией у пациентов с повторными ИИ, особую актуальность приобретает проблема приверженности гиполипидемической терапии. Несмотря на наличие четких медицинских показаний, включая выраженные атеросклеротические поражения магистральных артерий, большая доля пациентов не получают терапию в полном объеме или прекращают ее преждевременно. Это в свою очередь снижает эффективность вторичной профилактики и повышает риск рецидива инсульта.
Для систематизации данных и контроля за соблюдением вторичной профилактики в исследовании использовались данные цифровой платформы «Порто-Вита», интегрированной в работу кабинета динамического наблюдения. Система обеспечивала централизованный доступ к медицинской информации, включая выписки из стационара, назначения гиполипидемической и антитромботической терапии, а также отметки о посещениях врачей и выполнении рекомендаций. Кроме того, «Порто-Вита» позволила отслеживать комплаентность в отдаленном периоде за счет синхронизации с электронными дневниками наблюдения, данными лабораторных анализов и анкет пациентов (табл. 2).

Следует подчеркнуть, что данные таблицы 2 (платформа «Порто-Вита») представляют собой независимую выборку пациентов, находившихся под амбулаторным динамическим наблюдением в период 2017–2023 гг., и не совпадают с основной когортой исследования (n=1971). Эти сведения были использованы для оценки общей динамики назначения и приверженности гиполипидемической терапии в популяции пациентов высокого сосудистого риска.
В выписках пациентов с ИИ из стационаров врачами рекомендуется гиполипидемическая терапия с указанием целевых показателей липидного спектра. Однако анализ регистра показал, что часть пациентов не принимают статины в соответствии с рекомендациями врачей. При этом обращает на себя внимание, что систематический контроль с применением цифровой платформы «Порто-Вита» способствовал повышению приверженности терапии. Данные за 7 лет, полученные в Кабинете динамического наблюдения, показывают положительную динамику в охвате пациентов с дислипидемией гиполипидемической терапией: если в 2017 г. лечение получали около 33% пациентов, то к 2020 и 2023 гг. этот показатель стабилизировался на уровне 46%. Несмотря на эти улучшения, процент пациентов, принимающих статины, не достигает целевых показателей, рекомендованных международными клиническими рекомендациями для групп лиц высокого сосудистого риска. В контексте настоящего исследования, включавшего 831 пациента с повторными острыми церебральными ишемическими событиями (ИИ и ТИА), общая приверженность гиполипидемической терапии (включая регулярный и нерегулярный прием) составила 43,7% (n=363). Из них 331 (39,8%) принимал препараты строго по назначению врача, еще 32 (3,9%) принимали их с нарушениями режима, в то время как почти половина пациентов — 468 (56,3%) — не получали гиполипидемическую терапию вовсе. Таким образом, уровень приверженности в группе пациентов с повторным инсультом оказался сопоставим с общим трендом, фиксируемым по данным платформы «Порто-Вита».
Сниженный уровень приверженности гиполипидемической терапии послужил мотивацией к изучению причин некомплаентности. Среди пациентов, не принимавших гиполипидемические препараты после повторного инсульта, основной причиной отказа в 164 (35,0%) случаях выступали жалобы на побочные эффекты или их ожидание. Наиболее часто упоминались мышечные боли, слабость, «тяжесть в печени», а также опасения по поводу влияния на память. Отказ от терапии в 117 (25,0%) случаях был связан с отсутствием симптомов и, как следствие, субъективной убежденностью пациента в ненужности лечения. Еще 70 (15,0%) пациентов не принимали препараты из-за недоверия к медикаментозной терапии в целом или к назначению врача. У 47 (10,0%) больных причиной являлись выраженные когнитивные нарушения, приводившие к невозможности самостоятельного контроля терапии. В 47 (10,0%) наблюдениях отказ обусловливался организационными барьерами, такими как отсутствие рецепта, физическая недоступность аптеки или невозможность регулярно пополнять запасы препарата. У оставшихся 23 (5,0%) пациентов решение об отказе принималось родственниками или опекунами, в том числе при наличии выраженной инвалидизации или социальной изоляции. Выявлено, что пациенты, проживающие в одиночестве или в сельской местности, имели значительно более низкие уровни приверженности гиполипидемической терапии (31,7 и 34,1%, соответственно) относительно пациентов, проживающих в семьях и в городе (47,1 и 49,5%, р<0,01). Кроме того, пациенты с наличием когнитивной дисфункции по шкале MoCA были менее комплаентными (28,4%), чем пациенты с неизмененным когнитивным статусом (52,7%, р<0,001).
Для оценки факторов, ассоциированных с отсутствием приема гиполипидемической терапии, был проведен анализ с применением многоуровневой логистической регрессии, в которой в качестве базовой выступала группа пациентов, регулярно принимавших статины (группа 0). Модель включала три независимые переменные: возраст, когнитивный статус по шкале MoCA и выраженность депрессии по шкале HADS (табл. 3). В анализ были включены также пациенты, не принимавшие препараты (группа 1), и пациенты с неустановленным статусом приема (группа 2). Согласно полученным результатам с увеличением возраста повышалась вероятность того, что пациент не принимал статины: отношение шансов (odds ratio, OR) составило 1,26, p=0,004. Полученные данные могут указывать на то, что с увеличением возраста снижается вероятность соблюдения режима гиполипидемической терапии, особенно в долгосрочной перспективе. Это может быть связано с нарастанием когнитивных трудностей, полиморбидностью, снижением мобильности и нарушением контроля за приемом препаратов. Таким образом, возраст может выступать как независимый фактор риска низкой приверженности вторичной профилактике. Когнитивные нарушения также оказались значимым фактором для группы с неустановленным статусом приема лекарств: снижение баллов по шкале MoCA сопровождалось снижением вероятности приема препарата (OR=0,96, p=0,032). Это предположительно связано с трудностями обратной связи при выраженном когнитивном дефиците, афазии или отсутствии информированных родственников. Показатели выраженности депрессии по шкале HADS не достигли статистической значимости ни в одной из моделей (p>0,05), однако выявленная тенденция требует дополнительного изучения в более крупной выборке.

На основании полученных результатов можно констатировать, что основными факторами, ассоциированными с несоблюдением рекомендаций приема гиполипидемической терапии, оказались пожилой возраст и снижение когнитивных функций.
Результаты настоящего исследования демонстрируют крайне низкий уровень приверженности гиполипидемической терапии среди пациентов с ИИ, несмотря на наличие четких клинических показаний и рекомендаций врачей при выписке из стационара. Согласно результатам исследования только 43,7% пациентов с повторным ИИ получали гиполипидемическую терапию, и лишь незначительная доля из них достигала целевых уровней ЛПНП. Эти данные соответствуют результатам предыдущих исследований, в том числе международных. В международных регистрах и когортных исследованиях также отмечается значительное снижение приверженности гиполипидемической терапии после инсульта: уже через 1 год лишь около 60% пациентов продолжают прием статинов, а к двум годам этот показатель снижается до 50% и менее [15–17].
Анализ структуры липидного профиля в зависимости от подтипа инсульта показал, что пациенты с атеротромботическим инсультом имеют наибольшие уровни общего холестерина и ЛПНП, что подчеркивает особую важность контроля липидного обмена именно в этой группе. У пациентов с повторным инсультом значения ЛПНП в среднем достигали 6,3 ммоль/л, в то время как уровень ТГ варьировал от 2,3 до 3,4 ммоль/л. Это свидетельствует о наличии выраженной дислипидемии у большинства больных, что требует как фармакологической, так и образовательной интервенции.
Наличие гемодинамически значимых стенозов магистральных артерий головы и шеи было выявлено у значительной доли пациентов — более 40% имели стенозы ≥50%. Однако даже в этой подгруппе уровень приверженности оставался неудовлетворительным. Это указывает на недостаточный уровень осведомленности как со стороны пациентов, так и со стороны врачей общей практики в отношении актуальности и жизненной необходимости контроля липидного профиля. K.K. Ray et al. [18] показали, что назначение гиполипидемической терапии в условиях стационара не всегда сопровождается последующим регулярным приемом препаратов после выписки.
Еще одним важным фактором, выявленным в исследовании, стало отсутствие адекватного контроля за терапией. У значительной доли пациентов был неуточненный статус терапии, что в большинстве случаев обусловлено когнитивными нарушениями, афазией или отсутствием информированных родственников. Низкий уровень когнитивных функций, подтвержденный данными шкалы MoCA, оказался значимым фактором отказа от терапии. Эти данные согласуются с результатами исследования X. He et al. [19], обнаруживших, что даже умеренные когнитивные нарушения более чем в 2 раза увеличивают риск неприверженности терапии.
Также было определено, что пациенты, проживающие в одиночестве или в сельской местности, имели значительно более низкие уровни приверженности, что ранее уже обсуждалось в работах зарубежных авторов [20, 21]. Эти факторы должны учитываться при формировании персонализированных стратегий ведения пациентов после инсульта.
Кроме того, стоит отметить, что, по данным отчета Кабинета динамического наблюдения ГАУЗ «ГКБ № 7 им. М.Н. Садыкова» (2021–2022), большая часть пациентов, даже имея уровень ЛНП выше 3,5 ммоль/л, не получали адекватной терапии или получали ее нерегулярно. Среди назначаемых препаратов преобладали аторвастатин и розувастатин, однако их дозировки часто были недостаточными. В среднем назначаемая доза аторвастатина составляла 20–30 мг/сут, а розувастатина — 10–15 мг/сут, что ниже рекомендованных высоких дозировок, предусмотренных клиническими рекомендациями для пациентов с высоким сосудистым риском. Эзетимиб, несмотря на включение в клинические рекомендации, применялся крайне редко — менее чем у 5% пациентов. Это подтверждает международные наблюдения о низкой частоте использования комбинированной терапии даже при очевидной неэффективности монотерапии статинами [8].
В контексте расширения возможностей гиполипидемической терапии заслуживают внимания лекарственные средства из группы PCSK9-таргетной терапии, в частности препарат инклисиран (Сибрава) — препарат миРНК, направленный на ингибирование синтеза PCSK9 в печени. В отличие от моноклональных антител к PCSK9, инклисиран реализует эффект через снижение экспрессии белка на уровне матричной РНК, обеспечивая более стабильное и продолжительное угнетение его продукции [22]. Клинические исследования (ORION-10, ORION-11) продемонстрировали снижение уровня ЛПНП на 50% и более при удобном режиме введения препарата — лишь 2 раза в год после загрузочной схемы [22, 23]. Такой фармакокинетический профиль потенциально улучшает приверженность терапии за счет редких инъекций и минимального бремени получения терапии для пациента [24]. Инклисиран одобрен для использования у пациентов с установленным атеросклерозом или высоким сердечно-сосудистым риском в случаях, когда целевые уровни ЛПНП не достигаются на фоне максимально переносимых доз статинов как в монотерапии, так и в комбинации с другими гиполипидемическими средствами [23]. Включение инклисирана в стратегию вторичной профилактики инсульта представляется перспективным направлением для индивидуализации терапии и преодоления проблемы неадекватного контроля липидного обмена в реальной клинической практике.
Полученные результаты подчеркивают необходимость системной реорганизации подходов к ведению пациентов с ИИ и особого внимания к вопросам приверженности и персонализированной мотивационной поддержки.
Анализ показателей липидного спектра крови как у пациентов с первичным острым церебральным ишемическим сосудистым событием, так и при повторных инсультах и ТИА выявил нарушение липидного обмена, что определяет значимость назначения гиполипидемической терапии с достижением целевых показателей ЛПНП. Наиболее высокий уровень общего холестерина и ЛПНП наблюдался у пациентов с атеротромботическим инсультом, что подчеркивает необходимость агрессивной коррекции липидного обмена в данной группе. Однако и пациенты с другими патогенетическими подтипами инсульта нуждаются в назначении адекватной гиполипидемической терапии в соответствии с клиническими рекомендациями. Повторные инсульты ассоциировались с более тяжелым нарушением липидного обмена и недостаточной медикаментозной коррекцией, что указывает на возможную кумуляцию рисков вследствие хронической некомплаентности.
Особое значение имеет выявление у значительной доли пациентов гемодинамически значимых стенозов магистральных артерий головы и шеи, что требует не просто профилактической, а патогенетически ориентированной гиполипидемической терапии с использованием высокоинтенсивной и, при необходимости, комбинированной гиполипидемической терапии. В последние годы все больше внимания уделяется инклисирану как инновационной опции в стратегии снижения ЛПНП у пациентов с высоким сердечно-сосудистым риском. Клинические исследования и метаанализы продемонстрировали его способность обеспечивать стойкое снижение уровня ЛПНП примерно на 50% при редком режиме введения (дважды в год) и хорошую переносимость на протяжении нескольких лет наблюдения [23–26]. Такие данные позволяют рассматривать инклисиран как перспективный компонент персонализированного подхода к вторичной профилактике инсульта.
Проведенное нами исследование выявило низкий уровень приверженности гиполипидемической терапии пациентов с ИИ, особенно в подгруппе с повторными острыми цереброваскулярными событиями. Несмотря на доказанную эффективность статинов и необходимость достижения целевых уровней ЛПНП (<1,4 ммоль/л) у пациентов с очень высоким сосудистым риском, только 43,7% обследованных лиц получали гиполипидемическую терапию и лишь у незначительного числа пациентов фиксировалось достижение целевых показателей липидного спектра. Более того, эзетимиб как препарат второй линии использовался крайне редко, несмотря на его значимость в рамках современных клинических рекомендаций при недостаточной эффективности статинов. Очень важна преемственность между сосудистыми центрами и врачами общей практики для максимального соблюдения стратегий вторичной профилактики и персонализированной терапии пациентов.
Полученные результаты подчеркивают важность назначения высокоинтенсивной терапии статинами как основы гиполипидемической стратегии у пациентов с ИИ и ТИА. Современные клинические рекомендации3 предусматривают четкую этапность эскалации терапии при недостижении целевых уровней холестерина ЛПНП — с добавлением к статинам эзетимиба, а при недостаточной эффективности этой комбинации — PCSK9-таргетной терапии, включая моноклональные антитела и миРНК (инклисиран (Сибрава)). Такой подход обеспечивает возможность индивидуализированного контроля липидного обмена и повышения приверженности терапии в рамках вторичной профилактики инсульта.
Заключение
Таким образом, результаты настоящего исследования подчеркивают необходимость не только соблюдения протоколов фармакотерапии в соответствии с клиническими рекомендациями, но и внедрения программ повышения приверженности с участием мультидисциплинарных команд: врачей, клинических фармакологов, психологов и социальных работников. Это особенно важно в условиях реальной клинической практики, где приверженность терапии остается одним из ключевых факторов, определяющих исход заболевания. Оптимизация стратегии гиполипидемической терапии может стать одним из эффективных путей снижения повторных острых церебральных сосудистых катастроф, инвалидизации и смертности.
СВЕДЕНИЯ ОБ АВТОРАХ:
Валеева Кадрия Гусмановна — врач-невролог ГАУЗ «ГКБ № 7 им. М.Н. Садыкова»; 420103, Россия, г. Казань, ул. Маршала Чуйкова, д. 54; ORCID iD 009-0001-4699-9257
Данилова Татьяна Валерьевна — д.м.н., доцент кафедры неврологии ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0001-6926-6155
Хасанова Дина Рустемовна — д.м.н., профессор кафедры неврологии ФГБОУ ВО Казанский ГМУ Минздрава России; 420012, Россия, Казань, ул. Бутлерова, д. 49; ORCID iD 0000-0002-8825-2346
Контактная информация: Валеева Кадрия Гусмановна, e-mail: valeevakadria@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.06.2025.
Поступила после рецензирования 04.07.2025.
Принята в печать 29.07.2025.
ABOUT THE AUTHORS:
Kadriya G. Valeeva — Neurologist at City Clinical Hospital No. 7 named after M.N. Sadykov; 54, Marshal Chuikov str., Kazan, 420103, Russian Federation; ORCID iD 009-0001-4699-9257
Tatiana V. Danilova — Dr. Sc. (Med.), Assistant Professor of the Department of Neurology, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0001-6926-6155
Dina R. Khasanova — Dr. Sc. (Med.), Professor of the Department of Neurology, Kazan State Medical University; 49, Butlerov str., Kazan, 420012, Russian Federation; ORCID iD 0000-0002-8825-2346
Contact information: Kadriya G. Valeeva, e-mail: valeevakadria@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.06.2025.
Revised 04.07.2025.
Accepted 29.07.2025.
1Всемирная организация здравоохранения. Инсульт — глобальная статистика и профилактика. (Электронный ресурс.) URL: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (дата обращения: 09.06.2025).
2Российское медицинское общество по артериальной гипертонии, Национальное общество по изучению атеросклероза. Ишемический инсульт и транзиторная ишемическая атака. Клинические рекомендации. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recommend/145_1 (дата обращения: 09.06.2025).
3Ишемический инсульт у взрослых. Клинические рекомендации. Министерство здравоохранения Российской Федерации. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/view-cr/814_1?ysclid=mgtamv2tb2370733357 (дата обращения: 09.06.2025).