Введение
Когнитивные расстройства (КР) представляют собой исключительно серьезную проблему в современном мире в связи с их широкой распространенностью и высоким риском прогрессирования с переходом в тяжелую деменцию. При помощи методов математического моделирования показано, что к середине текущего столетия в мире будет проживать порядка 150 млн пациентов с развернутой деменцией [1]. Несомненно, эти цифры будут подвергаться коррекции. С одной стороны, ожидается дальнейшее усиление воздействия факторов риска, включая старение населения с увеличением в популяции доли лиц пожилого и старческого возраста, увеличение числа пациентов, перенесших тяжелые соматические заболевания (онкологические, сердечно-сосудистые), негативное воздействие условий окружающей среды. С другой стороны, имеются все основания ожидать появления доступных препаратов, способных изменять течение заболевания и предупреждать формирование тяжелой деменции, обладающих приемлемым соотношением потенциальной пользы и риска, а также внедрения в практику эффективных стратегий профилактики КР. В любом случае медицинская значимость проблемы КР и деменции и экономическое бремя болезни многие десятилетия будут сохранять свою исключительную актуальность. Следует также отметить, что на протяжении последних трех десятилетий (с 1990 по 2020 г.) отмечается тенденция к более раннему развитию деменции, в частности, количество пациентов в возрасте 40–64 лет с деменцией за это время возросло вдвое [2]. Указанная тенденция касается как непосредственно болезни Альцгеймера, так и других ее форм, включая сосудистую и смешанную деменцию. Установление причин «омоложения» деменции требует изучения, но не вызывает сомнения необходимость разработки новых подходов к лечению и профилактике КР, способов замедления их превращения в тяжелую деменцию именно среди молодых пациентов.
На сегодняшний день разработаны и внедрены в клиническую практику методы лекарственного лечения пациентов с КР [3]. Терапевтическая тактика определяется в первую очередь выраженностью КР, а также тем влиянием, которое они оказывают на повседневную жизнь пациента. Обоснованность назначения лекарственной терапии в значительной степени определяется характером клинической картины КР и их влиянием на уровень повседневной активности пациента, степень его адаптации, потребность в посторонней помощи и уходе. Помимо собственно препаратов, способных оказать влияние на течение КР и замедлить наступление деменции, лечение включает назначение препаратов для устранения широкого спектра некогнитивных нервно-психических нарушений (эмоциональных, поведенческих, психотических).
Лечение пациентов с недементными КР
Ведение пациентов с недементными КР направлено на достижение следующих ключевых задач: замедление их прогрессирования (профилактика деменции), уменьшение выраженности КР, а также снижение влияния КР на повседневную жизнь пациента. Раннее выявление КР дает возможность предпринять соответствующие меры для замедления их прогрессирования и отложить во времени сроки наступления тяжелой деменции. Несмотря на, казалось бы, очевидную перспективность максимально раннего начала активной лекарственной терапии на стадии додементных КР, убедительных данных, свидетельствующих о существенных преимуществах различных направлений медикаментозной терапии у пациентов с недементными КР, не получено. Среди пациентов с умеренными КР (УКР) проведен ряд исследований в целях изучения применения препаратов с разной химической структурой и разными клиническими эффектами, способных замедлять течение КР. Изучалась возможность применения нестероидных противовоспалительных препаратов, лекарственных средств, оказывающих нейротрофические эффекты, витаминов D, Е, С, группы В, их комбинаций, препаратов растительного происхождения [4, 5]. Убедительного подтверждения положительного эффекта таких вмешательств получено не было, что, вероятно, может быть обусловлено особенностями дизайна исследований (недостаточная мощность, относительно короткий период вмешательства и наблюдения, разнородность включенных в них пациентов и пр.), разнообразием причин развития КР. В этой связи исключительный интерес представляют нелекарственные средства профилактики деменции, способные замедлить прогрессирование процесса при раннем начале их применения, на стадии додементных нарушений [6, 7].
В качестве препаратов базовой терапии для лечения пациентов с КР рассматриваются ингибиторы ацетилхолинэстеразы (ИАХЭ) (ривастигмин, галантамин, донепезил, ипидакрин), а также лекарственное средство, угнетающее избыточную активность глутаматергической нейротрансмиссии (мемантин). На сегодняшний день отсутствуют убедительные сведения об эффективности применения препаратов из группы ИАХЭ для лечения пациентов с УКР [3]. Результаты серии проведенных клинических исследований показали определенный эффект такого рода терапии [8, 9]. Уровень убедительности такого рода рекомендаций — В (уровень достоверности доказательств — 2).
Для лекарственного лечения пациентов с додементными формами КР в настоящее может быть использован широкий спектр лекарственных препаратов, который включает ноотропы, полипептидные препараты, обладающие мультимодальными эффектами, антиоксиданты и антигипоксанты, некоторые производные растительного сырья. Многочисленные исследования продемонстрировали положительный эффект их применения в различных группах пациентов. Вместе с тем разнородность и особенности дизайна исследований, разнородность наблюдавшихся групп пациентов (возраст, причина и тяжесть КР, особенности коморбидности и пр.) не позволяют провести корректный систематический обзор и метаанализ полученных результатов. Результаты ряда клинических исследований дают веские основания полагать, что на стадии додементных расстройств эффективным может оказаться применение ипидакрина [10, 11]. Авторы исследований смогли установить положительный эффект применения препарата в виде улучшения состояния когнитивных функций, в первую очередь у пациентов с КР, обусловленных хроническими расстройствами мозгового кровообращения, а также со смешанными КР. С практической точки зрения важно, что применение ипидакрина, помимо положительного воздействия на состояние когнитивных функций, способно замедлить течение вегетативной полинейропатии, в частности у пациентов с сахарным диабетом 2 типа, что представляется исключительно важным в плане предупреждения нарастания цереброваскулярной патологии (за счет нормализации уровня системного артериального давления, улучшения ауторегуляции мозгового кровообращения, возможно, повышения эффективности антигипертензивной терапии) [12]. Благоприятный профиль переносимости ипидакрина и низкий риск развития лекарственных взаимодействий позволяют применять комбинированную терапию пациентов с додементными расстройствами — сочетание ипидакрина и препаратов других классов, способных оказывать положительное действие на работу головного мозга.
Лечение пациентов с деменцией
Лекарственная терапия, назначаемая пациентам с деменцией, включает базисное лечение — антихолинэстеразные средства (АХЭС), такие как ИАХЭ ривастигмин, галантамин, донепезил, ипидакрин и антагонист глутаматных NMDA-рецепторов мемантин, дополнительную терапию (адъювантные средства, назначение которых — потенцирование основных эффектов базисных препаратов), а также симптоматическое лечение, направленное на уменьшение выраженности или полное купирование недементных нейропсихических расстройств.
Ключевым механизмом действия препаратов из группы АХЭС является устранение дисбаланса нейротрансмиттеров за счет увеличения концентрации ацетилхолина в синаптической щели. Указанная цель достигается в первую очередь угнетением активности ферментов, которые участвуют в разрушении ацетилхолина. Данные препараты не только влияют на ключевые проявления КР, но также способствуют улучшению общего функционального статуса пациента, повышению качества жизни как самого пациента, так и окружающих его людей, оказывают положительное влияние на выраженность некогнитивных нервно-психических расстройств [3].
Вместе с тем нельзя исключить, что препараты данной группы могут иметь и другие точки приложения в центральной нервной системе (ЦНС), и их действие не ограничивается исключительно восполнением дефицита ацетилхолина [13].
Препараты из группы ИАХЭ, наряду с мемантином, являются основными средствами для лечения пациентов с деменцией различной степени тяжести при болезни Альцгеймера, деменции сосудистой и смешанной, а также деменции с тельцами Леви. Вместе с тем результаты ряда проведенных проспективных исследований свидетельствуют о том, что раннее начало применения препаратов ИАХЭ (ривастигмин, галантамин, донепезил) не оказывает значимого влияния на течение заболевания и не сопровождается увеличением времени до развития тяжелой деменции, т. е. такого рода терапия не оказывает болезнь-модифицирующего эффекта. Авторами исследования было отмечено увеличение частоты случаев возникновения нежелательных явлений (НЯ), в первую очередь со стороны сердечно-сосудистой системы и желудочно-кишечного тракта. В соответствии с полученными данными раннее применение препаратов ИАХЭ считается нецелесообразным при ведении пациентов с УКР. Вместе с тем, принимая во внимание тот факт, что четкое разделение синдрома УКР и легкой деменции в реальной клинической практике не всегда возможно в силу объективных причин, решение вопроса о назначении этих препаратов требует тщательного анализа конкретной клинической ситуации.
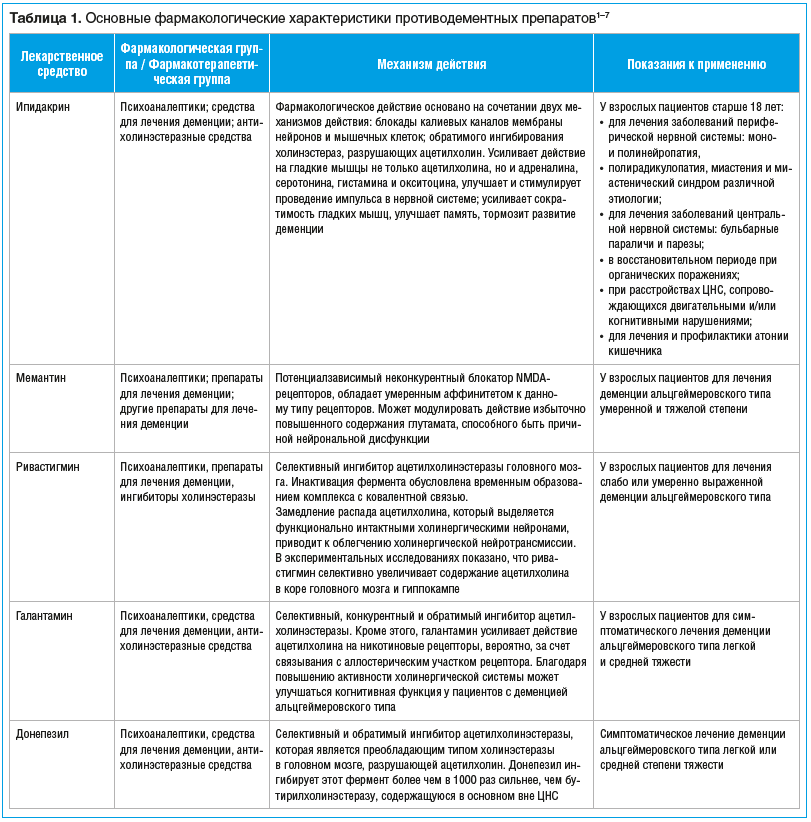
Фармакологические характеристики основных противодементных препаратов
Основные характеристики противодементных препаратов представлены в таблице 1.

Ипидакрин. Ингибитор холинэстеразы. Препятствует ферментному гидролизу ацетилхолина и удлиняет его действие. Блокирует калиевые каналы мембран и способствует их деполяризации. При пероральном приеме быстро всасывается в кишечнике. До 40–55% активного вещества связывается с белками плазмы крови. Максимальная концентрация (Cmax) в плазме крови достигается примерно через 1 ч. Ипидакрин быстро поступает в ткани, период полураспределения составляет порядка 40 мин. Метаболизируется в печени, выводится в первую очередь почками с мочой (в основном за счет канальцевой секреции, только около 30% дозы — путем клубочковой фильтрации)1.
Мемантин. Представляет собой неконкурентный антагонист NMDA-рецепторов глутамата2,3. После перорального приема хорошо всасывается в кишечнике, биодоступность (F) мемантина приблизительно равна 100%. Cmax в плазме достигается через 3–8 ч. Связывание с белками плазмы крови составляет 45%. Частично метаболизируется в печени, неизмененный мемантин и его метаболиты выводятся преимущественно почками. Период полувыведения (t1/2) составляет 60–100 мин.
Ривастигмин. Представляет собой карбонатное соединение, обладает свойствами ингибитора ацетил- и бутирилхолинэстераз в головном мозге. После перорального приема быстро и полностью всасывается, Cmax в плазме крови достигается примерно через 1 ч. В слабой степени (до 40%) связывается с белками плазмы, легко преодолевает гематоэнцефалический барьер. Быстро гидролизуется холинэстеразой (основной путь катаболизма), метаболиты выводятся с мочой, в неизмененном виде ривастигмин в моче не обнаруживается. Через кишечник возможно выведение менее 1% дозы. Более 90% принятой перорально дозы препарата выводится из организма на протяжении 24 ч. У пациентов с болезнью Альцгеймера кумуляции ривастигмина или его декарбамилированного метаболита не отмечается4.
Галантамин. Третичный алкалоид, селективный, конкурентный и обратимый ингибитор ацетилхолинэстеразы. Кроме этого, галантамин усиливает действие ацетилхолина на никотиновые рецепторы, вероятно, за счет связывания с аллостерическим участком рецептора. Скорость абсорбции галантамина высокая, время достижения максимальной концентрации (tmax) составляет около 1 ч. Абсолютная F высокая — 88,55±5,4%. При пероральном приеме галантамина в лекарственной форме таблетки, покрытые пленочной оболочкой, прием пищи снижает скорость абсорбции и уменьшает Сmах примерно на 25%, не влияя на степень абсорбции, вычисляемой по площади под фармакокинетической кривой «концентрация — время» (AUC). Исследования in vitro показали, что основными изоферментами системы цитохрома Р450 (cytochrome P450, CYP), участвующими в биотрансформации галантамина, являются CYP2D6 и CYP3A4. Изофермент CYP2D6 участвует в образовании О-десметилгалантамина, а изофермент CYP3A4 — N-оксид-галантамина. Выведение галантамина носит биэкспоненциальный характер. Конечный t1/2 у здоровых добровольцев составляет 7–8 ч. По результатам изучения галантамина немедленного высвобождения в популяционных исследованиях, клиренс при приеме галантамина внутрь в целевой популяции, как правило, составляет около 200 мл/мин с межиндивидуальной вариабельностью 30%. Через 7 дней после однократного приема внутрь 4 мг 3Н-галантамина 90–97% радиоактивной дозы выводится почками в виде неизмененного галантамина и 2,2–6,3% — кишечником. После внутривенного введения и приема внутрь 18–22% дозы выводилось в виде неизмененного галантамина почками в течение 24 ч. Почечный клиренс составил 68,4±22 мл/мин (20–25% общего плазменного клиренса)5,6.
Донепезил. Производное пиперидина, представляет собой селективный обратимый ингибитор АХЭ, его способность подавлять активность АХЭ более чем в 1000 раз превосходит таковую в отношении бутирилхолинэстеразы. Считается, что вследствие высокой селективности по отношению к ацетилхолинергическим рецепторам его назначение редко сопровождается выраженными НЯ. Донепезил хорошо всасывается из желудочно-кишечного тракта, относительная F при приеме внутрь составляет 100%. После приема внутрь tmax в плазме крови составляет 3–4 ч. Плазменные концентрации лекарственного средства и AUC увеличиваются дозозависимо. Установлено, что t1/2 донепезила из плазмы крови составляет около 70 ч, в связи с этим в случае регулярного применения в однократных дозах равновесное состояние достигается на протяжении 2–3 нед. с момента начала лечения. После достижения равновесной концентрации донепезила в плазме крови фармакодинамическая активность в течение дня существенно не изменяется. Аналогичным образом практически стабильными остаются и клинические эффекты препарата. Прием пищи на всасывание донепезила не влияет. Около 95% поступившего в организм донепезила связывается с белками плазмы. Непосредственно донепезил и/или его метаболиты могут сохраняться в организме более 10 сут. Донепезил метаболизируется в печени, неизмененное лекарственное средство и его метаболиты выводятся преимущественно почками, 79% дозы обнаруживается в моче и 21% — в кале7.
Дозировки препаратов перечислены в таблице 2.
![Таблица 2. Препараты для лечения пациентов с деменцией и их дозировки (по [3]) Таблица 2. Препараты для лечения пациентов с деменцией и их дозировки (по [3])](https://www.rmj.ru/upload/medialibrary/e3d/pwjbo2bobzcdgpy9cmsjelwx563stysz/18-2.png)
Трудности лечения пациента с деменцией
Если ключевыми целями лечения пациента с додементными КР являются улучшение когнитивного функционирования и замедление их превращения в деменцию, то на стадии деменции целями лечения являются замедление прогрессирования дементных нарушений, коррекция имеющихся расстройств повседневной активности и сопутствующих недементных нейропсихических расстройств, включая апатию, депрессию, диссомнические нарушения, у части пациентов — бреда и галлюцинаций. Задачами коррекции когнитивных нарушений, эмоциональных и поведенческих расстройств у пациентов с деменцией является не только улучшение состояния самого пациента, но и облегчение ухода за больным, а также поддержание достаточного уровня качества жизни ухаживающих за пациентом специалистов и родственников. В этой ситуации следует принимать во внимание, что сложности общения с пациентом с деменцией в значительной степени обусловлены не только непосредственно КР, но и поведенческими и эмоциональными расстройствами. В связи с этим требуется адекватный подход к их коррекции, позволяющий добиться купирования таких расстройств при минимальных рисках развития НЯ.
Серьезной проблемой ведения пациента с деменцией является своевременное выявление и коррекция соматических заболеваний, как остро возникших, так и связанных с текущими хроническими патологическими состояниями. Сложности общения с пациентом с деменцией значительно ограничивают возможность правильной интерпретации жалоб, сбора анамнеза, что может вести к позднему установлению диагноза соматического заболевания. Эффективным направлением ведения больного, позволяющим снизить риск развития соматических осложнений, является продуманный выбор лекарственных препаратов, назначение лекарственных средств, обладающих минимальным риском развития НЯ у конкретного пациента и прогнозируемым риском развития лекарственных взаимодействий. Важными являются тщательный учет имеющихся соматических заболеваний и анализ лекарственных назначений, сделанных по их поводу.
На сегодняшний день отсутствуют убедительные сведения об отличиях противодементного действия различных АХЭС. При наличии клинических показаний к назначению противодементных препаратов и решении о начале лечения следует ориентироваться не только на возможность достижения положительного эффекта, но и на потенциальные риски терапии, что требует выбора оптимального для конкретного пациента препарата.
Проведение лечения требует контроля его эффективности, который может быть основан как на полуколичественной оценке состояния когнитивных функций пациента (соответствующие шкалы и опросники), так и на определении степени повседневного, когнитивного и социального функционирования. В данной ситуации результаты клинического осмотра пациента, нейропсихологического тестирования могут быть подтверждены объективной информацией, полученной от ухаживающих или совместно проживающих с ним лиц. Принимая во внимание, что одним из следствий противодементной терапии может быть коррекция недементных нейропсихических нарушений, на их динамику также следует обращать внимание. Важным следствием такой оценки может быть решение о назначении или неназначении дополнительной терапии для коррекции нарушений поведения и/или настроения (антипсихотики, антидепрессанты, снотворные и пр.). То, насколько проводимое лечение влияет на общее состояние пациента, изменяет его способность к конструктивному контакту, облегчает мероприятия по уходу за ним, может служить важным критерием эффективности лечения. Надежными критериями эффективности проводимой адекватной ацетилхолин-ергической терапии (включая должные дозы препаратов и соблюдение режима их приема) считаются улучшение когнитивного состояния пациента или стабилизация симптомов на протяжении 6 мес. и более [3]. Родственников, близких, а также лиц, осуществляющих уход за больным, следует информировать о низкой вероятности раннего наступления положительного эффекта от лечения и необходимости настойчивого проведения медикаментозного лечения и выполнения других врачебных рекомендаций.
Суточные дозировки препаратов не должны превышать максимальные рекомендованные. Применять препарат следует столь долго, пока его применение оказывает положительный эффект (по мнению лечащего врача) и потенциальная польза от лечения превышает возможные риски. В том случае, если эффект от проводимой терапии перестает быть значимым и КР нарастают, оптимальной тактикой будет назначение другого препарата из рассматриваемой группы. На практике ответ на проводимую терапию бывает сугубо индивидуальным и не всегда может поддаваться точному прогнозу, поэтому переход на другой препарат при неэффективности первого считается целесообразным [14]. Также целесообразной представляется замена препарата при его плохой переносимости или развитии лекарственных взаимодействий [15, 16].
Накопленный значительный практический опыт, результаты клинических и экспериментальных исследований свидетельствуют об определенных отличиях НЯ и рисках лекарственных взаимодействий при применении противодементных препаратов в условиях комбинированного лечения. Вероятность НЯ повышается при наличии сопутствующих соматических (в ряде случаев и психических) заболеваний. Несмотря на хорошую переносимость противодементных препаратов даже в условиях длительного применения, при выборе лечебной тактики следует принимать во внимание наличие сопутствующих заболеваний, требующих тщательного выбора конкретного препарата с учетом соотношения риска и пользы. Перечень основных заболеваний и состояний, требующих осторожности при назначении противодементных препаратов, приведен в таблице 3.

Ограничения применения препаратов из группы ИАХЭ обусловлены холиномиметическими эффектами, в первую очередь в виде урежения частоты сердечных сокращений и замедления внутрисердечной проводимости, ульцерогенного эффекта с повышением риска развития язвы желудка и/или двенадцатиперстной кишки, затруднения мочеиспускания. Выраженная почечная и/или печеночная недостаточность также может ограничивать применение указанных препаратов. Благоприятным профилем переносимости, в частности отсутствием холиномиметического эффекта, характеризуется мемантин. В значительной степени это делает его применение перспективным у ряда пациентов пожилого возраста с сопутствующими сердечными, бронхолегочными и другими расстройствами.
Несмотря на сходный механизм действия и близкие риски развития межлекарственных взаимодействий, основные противодементные препараты имеют некоторые отличия, что следует принимать во внимание при их назначении. В особенности это важно при планировании тактики лечения пациентов, которые не в состоянии в полной мере описать свое самочувствие, но нуждаются в приеме большого количества лекарственных препаратов вследствие имеющейся полиморбидности. ИАХЭ не следует применять одновременно с другими АХЭС, так как при этом наблюдается высокая вероятность антагонизма по отношению к требуемому холиномиметическому эффекту. С другой стороны, нецелесообразно одновременное назначение и других АХЭС, а также холиномиметиков. В этой связи следует отметить серьезную проблему медикаментозного лечения пациентов с болезнью Паркинсона и КР, в частности нежелательность применения антихолинергических препаратов [15]. Такого рода комбинации способны дополнительно усиливать действие друг друга, причем выраженность эффекта не всегда предсказуема (табл. 4).

Метаболизм ривастигмина и донепезила в незначительной степени связан с активностью ферментов CYP, в связи с чем вероятность лекарственных взаимодействий с другими препаратами, катаболизм которых связан с этой ферментной системой, относительно невелика. С другой стороны, изоферменты CYP2D6 и CYP3A4 тесно связаны с трансформацией в организме галантамина. В связи с этим вероятность лекарственных взаимодействий может возрастать при одновременном назначении галантамина и препаратов, метаболизирующихся изоферментом CYP2D6 (его ингибиторы — фенитоин, пароксетин, сертралин, флуконазол, дифенгидрамин). Субстратами CYP2D6 также являются антиаритмические средства различных фармакологических групп, некоторые β-адреноблокаторы (метопролол, пропранолол), антипсихотики (хлорпромазин, клозапин), слабые опиоиды (кодеин, трамадол). Субстратами CYP3A4 являются многие противоопухолевые препараты (винкристин, винбластин, изатиниб, циклофосфамид, доксорубицин и пр.), препараты для лечения больных с аутоиммунными заболеваниями — иммуносупрессанты (такролимус, сиролимус, циклоспорин), антибиотики (кларитромицин, эритромицин), противогрибковые средства (кетоконазол, итраконазол), трициклические антидепрессанты (амитриптилин, имипрамин, кломипрамин и пр.), ингибиторы обратного захвата серотонина (циталопрам, сертралин и пр.) и ряд других препаратов.
Результатом взаимодействия, связанного с метаболизмом препаратов идентичными изоферментами CYP, может быть увеличение F галантамина и усиление выраженности его эффектов, как положительных, так и негативных. Вероятность развития лекарственных взаимодействий также зависит от ряда мутаций в генах, кодирующих экспрессию тех или иных изоферментов CYP, выявление которых в условиях реальной клинической практики не всегда возможно. Исходя из этого, следует учитывать, что риск взаимодействий возрастает при одновременном назначении нескольких препаратов, метаболизирующихся одним и тем же изоферментом, и риск имеет дозозависимый характер [17]. В случае невозможности отказаться от приема препаратов, метаболизирующихся одним изоферментом CYP, необходима тщательная титрация дозы противодементных препаратов.
Действие препаратов леводопы, антагонистов дофаминовых рецепторов, а также м-холиноблокаторов может усиливаться в случае одновременного назначения с мемантином. Назначение мемантина способно уменьшать эффективность антипсихотиков, что следует учитывать в клинических ситуациях, требующих их применения (возбуждение, галлюциноз у пациента с сочетанием деменции и психических нарушений). Эффективность баклофена и дантролена в случае назначения мемантина может изменяться как в сторону усиления, так и ослабления эффекта, что требует индивидуального подбора дозировок препаратов и определения необходимости их одновременного назначения. Также важно, что одновременное применение вместе с мемантином амантадина, фенитоина, декстрометорфана, кетамина может сопровождаться психомоторным возбуждением и повышает риск развития психоза. Такого рода эффекты, вероятно, обусловлены взаимодействием указанных препаратов с NMDA-рецепторами [18]. При назначении мемантина возможно повышение в крови концентрации ряда ингибиторов протонной помпы (ранитидин, циметидин), противоаритмических препаратов (хинидин, прокаинамид) вследствие участия в транспорте этих препаратов одной и той же катионной транспортной системы.
В целом применение мемантина характеризуется относительно невысоким риском лекарственных взаимодействий вследствие отсутствия значимого влияния на активность изоферментов CYP. Исследования in vitro, проведенные с субстратами — маркерами активности изоферментов CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1, CYP3A4, позволили установить, что мемантин способен лишь в незначительной степени угнетать их активность. Более того, результаты исследований in vitro продемонстрировали, что мемантин даже в концентрациях, превышающих терапевтические, не вызывает индукции изоферментов CYP1A2, CYP2C9, CYP2E1 и CYP3A4/5. Отсутствие значимых взаимодействий с изоферментами CYP может представлять собой ценное свойство мемантина, обеспечивающее возможность его применения у полиморбидных пациентов, нуждающихся в одновременном приеме большого количества лекарственных препаратов. Также было показано, что применение мемантина не изменяет активности таких ферментов, как флавинсодержащая монооксидаза, эпоксидгидролаза, а также ферменты, участвующие в процессах сульфатирования.
Широкая представленность препаратов для лечения деменции ставит перед врачами вопрос выбора эффективного, безопасного и доступного лекарственного средства. В настоящее время вся линейка противодементных препаратов основных химических классов выпускается ЗАО «Канонфарма продакшн» (Галантамин Канон, Донепезил Канон, Ривастигмин Канон, Мемантин Канон, Ипидакрин Канон), продукция которого проходит исследования биоэквивалентности согласно требованиям законодательства РФ в условиях строгого контроля качества.
Заключение
Лечение пациента с деменцией представляет собой сложную задачу. В процессе лечения требуется не только достижение улучшения когнитивных функций пациента или стабилизации его состояния, но и обеспечение максимально возможной его адаптации к повседневной жизни, уменьшение выраженности эмоциональных и поведенческих нарушений, облегчение процесса ухода за больным. Наиболее часто применяются препараты из группы ИАХЭ и неконкурентный антагонист NMDA-рецепторов глутамата мемантин. Несмотря на сходные показатели эффективности и переносимости, данные лекарственные средства могут отличаться профилем безопасности, переносимостью пациентами с соматическими заболеваниями, возможностью одновременного применения с другими лекарственными препаратами, что требует тщательного анализа клинической картины и выбора оптимальной тактики лечения. Разные механизмы действия препаратов дают возможность их применения при оказании помощи пациентам с различными формами деменции и другими неврологическими расстройствами.
1Общая характеристика лекарственного препарата Ипидакрин Канон, 20 мг, таблетки. (Электронный ресурс.) URL: https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
2Общая характеристика лекарственного препарата Мемантин Канон, 5 мг, 15 мг, 20 мг, таблетки, покрытые пленочной оболочкой. (Электронный ресурс.) URL: https//lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
3Общая характеристика лекарственного препарата Мемантин Канон, 10 мг, таблетки, покрытые пленочной оболочкой. (Электронный ресурс.) URL: https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
4Общая характеристика лекарственного препарата Ривастигмин Канон. (Электронный ресурс.) URL: https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
5Общая характеристика лекарственного препарата Галантамин Канон, 8 мг, 16 мг, 24 мг, капсулы с пролонгированным высвобождением. (Электронный ресурс.) https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
6Общая характеристика лекарственного препарата Галантамин Канон, 4 мг, 8 мг, 12 мг, таблетки, покрытые пленочной оболочкой. (Электронный ресурс.) https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).
7Общая характеристика лекарственного препарата Донепезил Канон, 5 мг, 10 мг, таблетки, покрытые пленочной оболочкой. (Электронный ресурс.) URL: https://lk.regmed.ru/Register/EAEU_SmPC (дата обращения: 13.03.2025).