Введение
В последние годы интенсивно развивается такое направление в медицине, как метабология. Однако в классических медицинских образовательных курсах ей пока уделяется недостаточно внимания. В связи с этим мы открываем цикл обзорных статей, посвященных метабологии, которая тесно связана с эндокринологией. Так как общепринятых определений рассматриваемых областей в настоящее время нет, вначале мы хотели бы дать наши определения терминов, основанные на изучении научных публикаций.
Метаболические заболевания — болезни или синдромы, при которых ведущим проявлением является нарушение обмена веществ, в том числе и преобразование энергетических субстратов в энергию в клетке, а также влияющие на течение внутриклеточных биохимических процессов энергообмена. К числу так называемых «метаболических болезней» можно отнести сахарный диабет (СД), ожирение. Кроме того, это могут быть нарушения обмена веществ, возникающие у терапевтических больных (например, вызванные диареей) или после хирургических вмешательств (например, бариатрических).
Метаболическая медицина — это профилактика, диагностика и лечение заболеваний, основанное на биохимических представлениях, а также генетической и молекулярной биологии, метаболических процессах в норме и при патологии.
Метаболическая терапия — это комплексный подход к лечению и профилактике заболеваний, основанный на коррекции метаболических процессов в организме. Он включает в себя диетические рекомендации, изменение образа жизни, физические упражнения и, при необходимости, медикаментозное вмешательство.
Предмет «Метаболическая медицина»
За последние годы метаболическая медицина превратилась в уникальную дисциплину, для освоения которой требуются как специальная общеклиническая подготовка, так и обширные биохимические знания.
Специалисты по нарушению обмена веществ (метабологи) лечат заболевания от самых распространенных до очень редких. Например, на консультацию к метабологу могут обратиться как пациенты с ожирением или метаболическим синдромом (МС), так и пациенты с митохондриальными заболеваниями или дефицитом массы тела неясной этиологии. Общим у таких пациентов является то, что каждый из них страдает болезнью, при которой нарушения в метаболизме служат основным этиологическим фактором заболевания, а лечение основывается на изменении питания и других терапевтических и хирургических методах воздействия на метаболизм.
Метаболическую медицину можно рассматривать как прикладную биохимию. Поэтому необходимо глубокое понимание биохимических метаболических путей. Это совершенно очевидно, когда речь идет о врожденном нарушении обмена веществ. Но также актуально и для лечения рядового пациента, страдающего СД 2 типа (СД2) или дислипидемией.
Метаболог должен обладать хорошими навыками в области физикального обследования и клинической диагностики пациентов с метаболическими нарушениями, по крайней мере на уровне врача общей практики. Кроме того, так как практически все гормоны, и прежде всего инсулин, обладают системным метаболическим эффектом, то необходима также основательная подготовка и в области эндокринологии.
Метаболог также должен иметь некоторый опыт и знания в области психологии и патопсихологии, поскольку лечение основывается в значительной мере на изменении образа жизни (в плане питания и физической активности, например).
Во всем мире программы обучения метаболической медицине различаются по своей глубине и сложности. Различия обусловлены высоким темпом развития этой области медицинских знаний, а также отличием в системах здравоохранения разных стран.
В России «метаболог» еще не включен в номенклатуру медицинских специальностей. В связи с этим врачи, специализирующиеся в области метаболической медицины, получают специализацию по нескольким медицинским направлениям (эндокринология, диетология, лечебная физкультура и др.). Вместе с тем «никому не объять необъятного». И потому в современной медицине постдипломное образование направлено на специализацию, а не на подготовку специалистов «широкого профиля», обладающих высокопрофессиональными навыками работы в разных медицинских направлениях.
Исходя из вышесказанного, целесообразно рассматривать метаболога в качестве организатора работы команды различных медицинских специалистов, оказывающих лечебную помощь больному в направлениях, которые задает метаболог.
Возникает вопрос: специалист какого направления в медицине в наилучшей степени подойдет для работы в качестве метаболога?
Очевидно, что это эндокринолог, особенно диабетолог, который в силу своей специальности достаточно глубоко изучает биохимию и энергообмен, знания которых, в частности, лежат в основе диетотерапии СД.
В США метаболическая медицина, как правило, включает три основных направления: недостаточное питание, ожирение и МС. В европейских странах больше внимания уделяется длительному наблюдению за пациентами с врожденным нарушением обмена веществ, поскольку большинство этих пациентов нуждаются в наблюдении и лечении пожизненно.
Кроме того, современные высокотехнологичные методы диагностики (например, анализ мочи на органические кислоты) позволяют диагностировать легкие, ранее не диагностировавшиеся формы наследственных метаболических заболеваний.
Этапы развития метаболической медицины
Развитие метаболической медицины целесообразно рассматривать с учетом эволюции науки о питании, так как они тесно связаны.
Возникновение направления «метаболическая медицина» было связано с необходимостью организации стационарного лечения пациентов, страдающих от недостаточного питания (фактически голодания). В связи с этим была начата подготовка специалистов в области интенсивного диетического лечения, которое включало, например, полное парентеральное питание и было основано на биохимии питания.
Возникновение в мире эпидемии ожирения в последние десятилетия и связанного с ним МС как фактора риска СД и сердечно-сосудистых заболеваний расширили востребованность в метаболической медицине от нишевой практики до широкого применения при распространенных заболеваниях.
Что касается диагностики и лечения синдрома недостаточного питания, то вначале оно касалось только тяжелых пациентов стационаров, страдающих по той или иной причине от недостатка поступления питательных веществ. Особый интерес к этой проблеме возник после Второй мировой войны, когда медицинское обслуживание стало переходить на новый, более технологичный уровень, а курс стационарного лечения пациентов становился все более длительным и сложным.
Большинство врачей той эпохи были незнакомы с научными концепциями и подходами в области питания. Они были плохо подготовлены к лечению пациентов, страдающих от тяжелого недоедания. С другой стороны, было мало разработано для клинической практики вариантов лечения или апробировано методик для проведения нутритивной терапии у истощенных пациентов [1, 2].
Развитие методов лечения недостаточного питания
Кардинальные изменения произошли в конце 1960-х годов, когда шведские ученые разработали и применили в клинике методы внутривенной нутритивной поддерживающей терапии, которая была названа «гипералиментацией» [3, 4].
Гипералиментация — это питание, избыточное по калорийности и нутритивному составу по сравнению с нормальным, разработанное специально для истощенных пациентов.
После того как было установлено, что в этой терапии нуждаются практически все больницы, были разработаны схемы парентерального и энтерального питания госпитализированных истощенных больных [3–7]. С тех пор появилось много новых препаратов для парентерального питания. Вместе с тем принцип нутритивного лечения остается очень близким к методике, впервые описанной шведскими учеными более полувека назад.
Группа нутритивной поддержки
Первоначальная функция врача — специалиста по болезням нарушения обмена веществ заключалась в руководстве многопрофильной группой, так называемой группой нутритивной поддержки (ГНП). В состав ГНП входили врач, диетолог, фармацевт и медсестра для проведения инъекций [8].
Создание таких мультидисциплинарных команд поддерживалось администрацией большинства больниц, поскольку для безопасного проведения гипералиментации необходимо было обеспечить многостороннее обоснование рекомендованной терапии. Однако по мере оптимизации лечения больницы стали сокращать расходы, связанные с работой ГНП, или даже их ликвидировать.
В определенный период времени ГНП эволюционировала в комплексную услугу, объединяющую консультативную деятельность по выявлению дефицита питания у пациентов, терапевтическую помощь для тех, кто сталкивается с подобными проблемами, а также помощь в установке центральных венозных катетеров. ГНП осуществляла мониторинг всех пациентов с недостаточным питанием, выполняя такие рутинные задачи, как замена катетеров и контроль лабораторных показателей; давала рекомендации и регулярно вносила коррективы в диету в зависимости от состояния пациента.
В связи с сокращением или ликвидацией должностей специалистов, входивших в ГНП, врач, занимающийся коррекцией нарушенного обмена веществ, оказался перед выбором: либо взять на себя функции специалистов ГНП, либо прекратить предоставление услуг по нутритивной поддержке.
Часть врачей прекратили свое участие в организации нутритивной поддержки стационарных больных из-за прекращения функционирования ГНП. Другие взяли на себя задачу объединения функций врача, диетолога, фармацевта и эксперта по проведению инъекций, чтобы стать консультантами по вопросам коррекции нарушенного обмена веществ у пациента, находящегося в стационаре.
В результате в задачи врача — специалиста по нутритивной поддержке вошли диагностика состояний недостаточности питания, разработка курса терапии, установка центрального венозного катетера, заказ парентерального питания и контроль проводимой терапии.
Примерно в то же время, когда на первый план вышла задача сокращения расходов в больницах на нутритивную поддержку, были разработаны более совершенные, но при этом упрощенные и безопасные методы парентерального питания. Например, были предложены безопасные для здоровья пациента липидные эмульсии для внутривенного введения (ВЛЭ).
Следует заметить, что первые лекарственные формы внутривенной жировой эмульсии были признаны токсичными и изъяты с фармрынка [9]. Однако позднее было установлено, что жировая эмульсия безопасна для внутривенного введения, если она имитирует естественный процесс переноса жира кровью. В частности, были разработаны искусственные хиломикроны [10], размер липидных глобул и биологические свойства которых были идентичны естественным хиломикронам.
Синтезированные ВЛЭ оказались эффективным средством лечения истощенных пациентов, так как позволяли насыщать организм пациента калориями, которыми богаты жиры. Кроме того, использование ВЛЭ позволило в два раза снизить количество калорий, поступающих в виде глюкозы, избыток которой в крови повышает риск развития СД.
Современные препараты для парентерального питания содержат сбалансированный состав энергосубстратов (белков, жиров и углеводов), а также покрывают физиологическую потребность в микроэлементах. Подход к нутритивной поддержке с точки зрения сбалансированного состава входящих в нее элементов противоречит устаревшей концепции «гипералиментации». В связи с этим было предложено для нутритивного питания другое, более адекватное определение: «полное парентеральное питание» [11].
Амбулаторная нутритивная поддержка
В конце 1970-х появилась новая парадигма оказания медицинской помощи: обеспечить бóльшую независимость и самостоятельность пациента в лечении своего заболевания.
Этот подход предполагает, что пациент является активным потребителем услуг здравоохранения, а не пассивным получателем помощи. В 1980-е годы необходимость ограничения затрат на стационарную помощь и потребность в большем участии пациента в процессе лечения привели к применению схем нутритивной поддержки у истощенных пациентов и после выписки из стационара [12]. В результате организация нутритивной поддержки на дому стала еще одной задачей метаболической медицины. Методы ухода на дому становились все более стандартизированными и рутинными, что позволило перейти к амбулаторному лечению пациентов методами парентерального питания.
Благодаря знаниям, полученным в ходе регулярного наблюдения за людьми, страдающими от недостатка питательных веществ, стало очевидно, что кроме недостатка энергосубстратов существуют и другие нутритивные дефициты, например нехватка в организме витаминов и минералов.
Такого рода дефициты часто наблюдаются у пациентов с синдромом короткого кишечника или кишечно-кожными свищами.
Позже данные метаболического мониторинга пациентов после бариатрических вмешательств еще больше расширили практические знания относительно дефицита микроэлементов и витаминов.
Ожирение и его лечение
Медицинское направление, связанное с профилактикой и лечением ожирения, также появилось в 1960-е годы, примерно в то же время, что и нутритивная поддержка пациентов с недостатком питания.
Следует заметить, что лечением ожирения занимаются врачи разных специальностей, преимущественно эндокринологи и диетологи и в меньшей степени терапевты и кардиологи. Для лечения они используют неинвазивные методы и в основном в амбулаторных условиях. Но сегодня в Интернете можно найти специалиста «обеситолога» (от англ. obese — «полный»), то есть специализирующегося на лечении ожирения.
Кто и как должен лечить ожирение?
Проблемы недостатка или избытка массы тела объединяет то, что в обоих случаях необходимо устранить дисбаланс в энергообмене. При этом у пациентов как с ожирением, так и дефицитом питания состав тела нарушен, а лечение направлено на его восстановление.
По мере того как проблема ожирения стала достигать масштабов эпидемии, в медицинском сообществе возникло понимание необходимости его профилактики и активного лечения.
Представляется очевидным, что врачи, специализирующиеся в лечении истощенных больных в стационаре (диетологи, например), могли бы применить полученные знания о метаболизме и для профилактики и лечения ожирения.
Для синтеза знаний и практических навыков врачей, занимающихся вопросами недостаточного питания, и теми, кто лечит ожирение, в 1970-х годах доктором G.L. Blackburn [13] была создана специальная образовательная платформа. Его концепция лечения ожирения называлась «модифицированное протеин-сберегающее голодание» (МПСГ) [13, 14], она была основана на его опыте стационарного лечения пациентов с ожирением специальной диетой с резким ограничением ее калорийности (лечебное голодание).
Его работы по изучению энергетического и азотного баланса при недостаточном питании получили высокую оценку медицинского научного сообщества, и он стал широко известен как лидер в области нутритивной поддержки. Внедрение программы МПСГ в клиническую практику стало одним из важных направлений метаболической медицины.
Научная концепция МПСГ была взята метабологами для лечения ожирения у некоторых пациентов. Оно проводилось в два этапа: вначале в стационаре, а затем продолжалось в амбулаторных условиях. МПСГ развилось и усложнилось настолько, что некоторые врачи сменили свою прежнюю специальность на нутрициологию как основной вид клинической деятельности.
С этого момента метаболическая медицина стала развиваться как самостоятельная специальность [15].
Метаболический синдром и профилактика сердечно-сосудистых заболеваний
Еще одно важное историческое событие в развитии метаболической медицины произошло через 10 лет после внедрения в практику МПСГ.
В 1988 г. доктор G.M. Reaven прочел ежегодную лекцию по лечебному голоданию в Стэнфордском университете. В этой лекции он высказал мнение, что ожирение, снижение толерантности к глюкозе, гиперлипидемия и гипертония связаны общей нитью — инсулинорезистентностью (ИР) [16]. И это сочетание патологических состояний он назвал «синдромом Х», в дальнейшем оно получило и другие названия: «метаболический синдром», «кардиометаболический синдром», «синдром Ривена». На сегодня общепринятым считается название «метаболический синдром».
С клинической точки зрения, МС — это сочетание центрипетального ожирения (увеличение окружности талии), артериальной гипертензии, дислипидемии (повышение в крови уровня триглицеридов и снижение уровня липопротеинов высокой плотности), а также нарушения толерантности к глюкозе (в том числе СД) [17], так называемый «смертельный квартет», поскольку на его фоне существенно возрастает риск смерти от сердечно-сосудистых заболеваний.
В последнее время к характерным признакам МС относят ряд биомаркеров воспаления, таких как высокочувствительный С-реактивный белок [18]. Кроме того, установлено, что неалкогольная жировая болезнь печени часто развивается у людей с ИР и МС [19].
Распространенность МС в развитых странах составляет более 25% [20] и, кроме того, он наблюдается у 75% пациентов с СД2 и у 50% пациентов с ишемической болезнью сердца (ИБС) [21]. Было также показано, что МС предшествует как СД, так и сердечно-сосудистым заболеваниям. Поэтому его раннее выявление и лечение являются важным инструментом профилактики сердечно-сосудистых заболеваний и смертности от них.
В практической деятельности метаболога треть его пациентов составляют пациенты с МС. Вместе с тем лечением СД2 на фоне МС занимаются эндокринологи. С учетом вышесказанного совместная работа эндокринолога и метаболога могла бы заключаться в том, что при МС метаболог назначает лечение, предотвращающее развитие СД2, а в тех случаях, когда СД2 развился, он передает лечение эндокринологу. Аналогично кардиологи лечат ИБС, атеросклероз и гипертонию на фоне МС, а врачи-метабологи в этом случае сосредоточены на их профилактике у лиц с МС.
Новые направления в области метаболической медицины
Знания в области метаболической медицины настолько расширились, что появилась возможность подбирать специальное диетическое лечение в зависимости от заболевания или комплекса болезней у пациента. В частности, роль метаболога может оказаться одной из ведущих в лечении не только признанных болезней нарушенного обмена, но, например, в неврологии, нефрологии, урологии, ревматологии, офтальмологии, иммунологии, пульмонологии, гастроэнтерологии, гепатологии, дерматологии и др. В этой связи метаболическая медицина может оказаться частью так называемой интегративной (прецизионной) медицины.
Бариатрическая/метаболическая хирургия
Новое развитие метаболическая медицина получила с внедрением и развитием бариатрической хирургии. С начала 1950-х годов были предложены различные виды бариатрических операций. Сегодня они условно подразделяются на 2 категории:
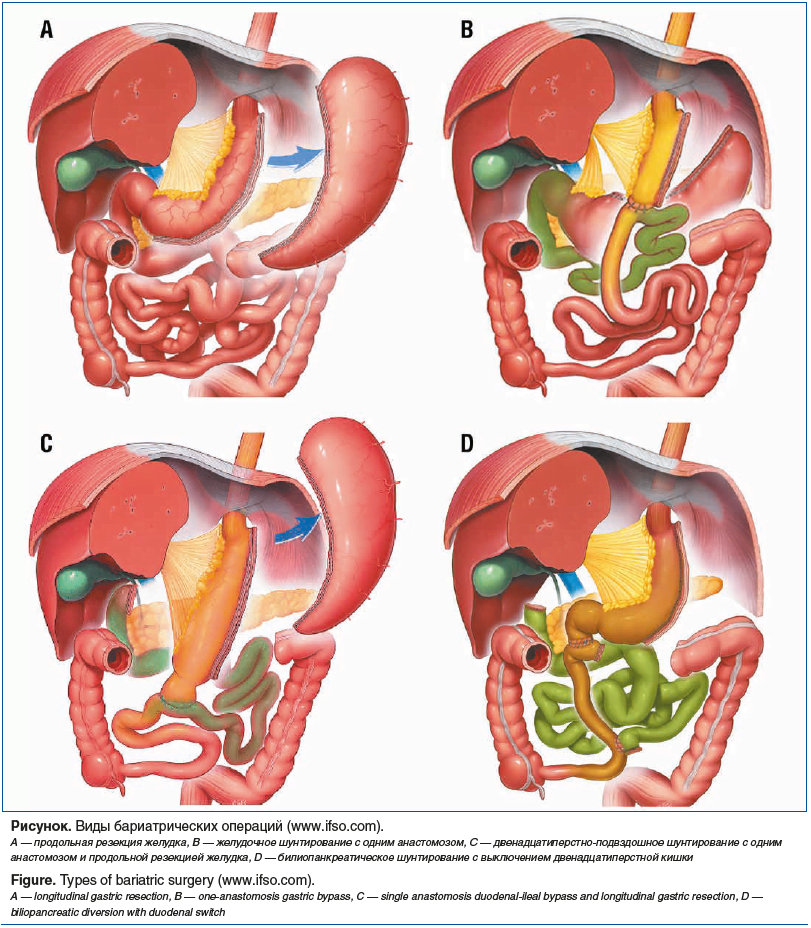
Рестриктивные (направлены на уменьшение размеров желудка, следствием чего являются уменьшение объема потребляемой пищи и снижение аппетита). Наиболее частой из них является продольная резекция желудка (см. рисунок, А).

Комбинированные (шунтирующие) (сочетают в себе два компонента: рестриктивный — уменьшение объема желудка, создаваемое различными способами, и мальабсорбтивный — снижение всасывания питательных веществ за счет уменьшения длины тонкой кишки, по которой продвигается пищевой комок).
Мальабсорбтивные операции в традиционном их понимании (еюноилеошунтирование, еюноколоношунтирование) были оставлены по причине возможного развития неконтролируемой избыточной мальабсорбции.
Важно отметить, что в отношении снижения массы тела и одновременной коррекции сопутствующей патологии наибольшей эффективностью обладают шунтирующие операции.
Принцип операции шунтирования желудка был разработан E.E. Mason в 1966 г. [22]. Он заметил, что у пациентов, перенесших резекцию желудка с гастроэнтеростомией, происходило заметное снижение массы тела. Автор предложил выполнять горизонтальную резекцию проксимальной части желудка, при которой приблизительно 1/5 (проксимальная) часть в области дна желудка анастомозируется с петлей тощей кишки примерно в 60 см от связки Трейца. Затем в 1977 г. J.F. Alden [23] модифицировал эту операцию, предложив выключение большей части желудка из пассажа пищи без резекции желудка, но эта операция не нашла широкого клинического применения.
Модификацию желудочного шунтирования по Ру (Roux-en-Y) впервые предложил W.O. Griffen [24] в 1977 г. Долгое время эта операция считалась «золотым стандартом» в бариатрической хирургии. У большинства пациентов она обеспечивала потерю до 75% избыточной массы тела (ИзМТ) через 2 года после выполнения и до 60% к 5 годам наблюдения. Также была отмечена ремиссия СД2 у 50% пациентов в течение 5 лет послеоперационного наблюдения.
В настоящее время существует несколько модификаций желудочного шунтирования, которые были предложены в связи с недостаточным эффектом стандартного варианта операции. В 1991 г. J.K. Torres разработал методику дистального гастрошунтирования с формированием алиментарной петли длиной 200–250 см [25]. Эта операция приводила к хорошей, более стойкой потере ИзМТ, но давала большее число побочных эффектов, связанных с избыточной мальабсорбцией и диарейным синдромом. В 1991 г. М. Fobi модифицировал желудочное шунтирование по Ру, дополнив его нерегулируемым бандажированием малого желудка (операция Fobi-Pouch), для усиления рестриктивного компонента и уменьшения проявлений демпинг-синдрома [26]. Данная модификация приводила к уменьшению растяжения малого желудка, но провоцировала развитие кислотного рефлюкса, что в принципе не является характерным побочным эффектом гастрошунтирования.
В 1997 г. R. Rutledge предложил новую модификацию операции, суть которой состояла в создании обходного желудочного шунта с использованием только одного анастомоза (минигастрошунтирование по Rutledg) (см. рисунок, B) [27]. Эта операция включает в себя разделение желудка на две части — большой (отключенный) желудок и малый узкий желудочек, сформированный вдоль малой кривизны, длиной 25 см, с внутренним диаметром 1,0 см — и формирование анастомоза между дистальным концом малого желудка и петлей тощей кишки на расстоянии 150–250 см от связки Трейца. Сравнительно недавно эффективность этой операции была оценена в крупномасштабном многоцентровом рандомизированном исследовании (исследование YOMEGA, 2019) [28]. Было показано, что при большей технической простоте выполнения и значительно более коротком времени выполнения минигастрошунтирования по Rutledg в сравнении с желудочным шунтированием по Ру обе операции одинаково эффективны в плане снижения ИзМТ, нормализации уровня глюкозы и гликированного гемоглобина. Однако у пациентов, перенесших минигастрошунтирование Rutledg, была выявлена более высокая частота дефицитов питательных веществ. По этой причине многие хирурги в настоящее время выступают за использование более короткой билиопанкреатической петли (150 см) при выполнении обеих модификаций желудочного шунтирования [29].
Несмотря на широкое использование и растущую популярность гастрошунтирования, следует отметить возможность специфических осложнений и побочных эффектов, таких как демпинг-синдром, язвы или стеноз гастроэнтероанастомоза, несостоятельность шва большого и малого желудков, развитие внутренних грыж, желчный рефлюкс. Также многие хирурги высказывают опасения относительно возможности развития злокачественных новообразований в большом желудке и невозможности его рутинного обследования при любом варианте гастрошунтирования.
Недостаточная эффективность желудочного шунтирования с точки зрения долгосрочного удержания сниженной массы тела и достижения длительной ремиссии СД2 все чаще заставляет хирургов прибегать к более эффективным, комбинированным бариатрическим операциям, таким как билиопанкреатическое шунтирование (см. рисунок, С, D).
Показатели потери ИзМТ (60%) и ремиссии СД2 (50%) к 5 годам наблюдения после желудочного шунтирования аналогичны во многих рандомизированных контролируемых исследованиях. Модификации билиопанкреатического шунтирования обеспечивают более существенную потерю ИзМТ (95–75%), значительно более высокую частоту длительной ремиссии СД2 и меньший риск его рецидива. При этом гастрошунтирование обеспечивает оптимальный гликемический и метаболический контроль у 50–60% пациентов с меньшим количеством побочных эффектов нарушения всасывания питательных веществ и микроэлементов, меньшую частоту развития диарейного синдрома, что в свою очередь позволяет многим пациентам оценивать качество жизни выше, чем после билиопанкреатического шунтирования. Этот факт позволяет предположить, что на сегодняшний день желудочное шунтирование имеет более благоприятное соотношение риска и пользы, чем билиопанкреатическое шунтирование, тогда как последнее может быть более эффективным у пациентов со сверхожирением и длительным анамнезом СД2.
Метаболическая хирургия определяется как «оперативное вмешательство на нормальном органе или системе органов для достижения биологического результата с целью потенциального улучшения здоровья» [30]. В отличие от бариатрической хирургии, которая направлена на снижение массы тела, основным принципом метаболической хирургии является лечение заболеваний с многочисленными клиническими проявлениями, сопутствующими морбидному ожирению, в первую очередь СД2.
В настоящее время не существует однозначного мнения относительно того, какая операция предпочтительнее, как и не существует конкретного алгоритма выбора операции с учетом клинических особенностей каждого пациента. Некоторые авторы полагают, что билиопанкреатическое шунтирование должно стать «золотым стандартом» бариатрической хирургии, так как обеспечивает более выраженное и наиболее стабильное снижение массы тела, а также уменьшение коморбидности по сравнению с желудочным шунтированием, при этом метаболический эффект билиопанкреатического шунтирования является максимальным по сравнению со всеми другими бариатрическими операциями. В то же время на сегодняшний день билиопанкреатические вмешательства продолжают оставаться сравнительно редкими из-за технических сложностей выполнения и в связи с более высокой опасностью развития послеоперационных осложнений, в частности избыточной мальабсорбции и диарейного синдрома.
Метабология и бариатрическая хирургия
Появление бариатрической хирургии и признание ее роли в значительном изменении метаболизма при ожирении (как в положительном, так и в отрицательном направлении) способствовало повышению востребованности во врачах-метабологах. Прежде всего потому, что оперированные пациенты сталкиваются с целым рядом нарушений в обмене микроэлементов, которые с увеличением длительности послеоперационного периода могут становиться все более выраженными.
Диагностика, профилактика и лечение недостаточности витаминов и микроэлементов, как правило, не входят в компетенцию бариатрического хирурга. Большинство терапевтов были также плохо подготовлены к точной диагностике и лечению этих состояний. Но врач-метаболог, обладающий опытом в лечении хронического недоедания, идеально подходит для решения этой клинической задачи.
Функционал врача-метаболога при ведении бариатрических пациентов
В дополнение к мониторингу, профилактике и управлению дефицитом микроэлементов, врач-метаболог призван помочь бариатрическим больным, при необходимости, корректировать сахароснижающую терапию СД2, а также схемы лечения гипотензивными и гиполипидемическими препаратами.
Врач-метаболог обычно берет на себя и лечение пациентов с синдромом ночного апноэ, в частности контроль за эффективностью CPAP-терапии (CPAP — Constant Positive Airway Pressure — режим искусственной вентиляции легких постоянным положительным давлением) по мере снижения массы тела.
При возникновении осложнений после бариатрической хирургии врач-метаболог должен использовать свои навыки в области нутритивной терапии, чтобы помочь бариатрическим пациентам, которые не могут самостоятельно соблюдать необходимый рацион питания. Особую тревогу вызывает подгруппа пациенток, которые беременеют в течение года после бариатрической операции и все еще быстро теряют в весе, несмотря на беременность.
Навыки врача-метаболога при медицинском снижении массы тела также полезны тем бариатрическим пациентам, которые испытывают трудности с достижением целевой массы тела. Около 20–40% пациентов после бариатрической хирургии отмечают рецидив набора массы тела, особенно после рестриктивных операций.
Заключение
Таким образом, в последние годы метабология приобретает все большее значение в медицине, особенно в контексте лечения метаболических заболеваний, таких как СД и ожирение. Однако значимость метабологии не всегда отражается в медицинских образовательных программах. В то же время глубокое понимание биохимических процессов и метаболических патологий является одним из определяющих факторов в достижении успеха в лечении. Развитие метаболической медицины и подходов к нутритивной поддержке представляет собой важный этап в современной медицине, обеспечивая эффективное лечение и повышение качества жизни пациентов с нарушениями обмена веществ.
Сведения об авторах:
Древаль Александр Васильевич — д.м.н., профессор, заведующий кафедрой эндокринологии и цифровой медицины ФУВ ФГБНУ «Национальный НИИ общественного здоровья имени Н.А. Семашко»; 105064, Россия, г. Москва, ул. Воронцово Поле, д. 12, стр. 1; ORCID iD 0000-0002-3135-9003
Нечаева Ольга Анатольевна — к.м.н., доцент кафедры эндокринологии и цифровой медицины ФУВ ФГБНУ «Национальный НИИ общественного здоровья имени Н.А. Семашко»; 105064, Россия, г. Москва, ул. Воронцово Поле, д. 12, стр. 1.
Древаль Олег Александрович — к.м.н., научный сотрудник отделения терапевтической эндокринологии отдела общей эндокринологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-8944-9837
Бритвин Тимур Альбертович — д.м.н., ведущий научный сотрудник отдела хирургии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0001-6160-1342
Габриелян Артур Рудольфович — профессор кафедры общественного здоровья и здравоохранения ФУВ ФГБНУ «Национальный НИИ общественного здоровья имени Н.А. Семашко»; 105064, Россия, г. Москва, ул. Воронцово Поле, д. 12, стр. 1.
Контактная информация: Древаль Александр Васильевич, e-mail: endocrinolog-cab@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.07.2024.
Поступила после рецензирования 05.08.2024.
Принята в печать 28.08.2024.
About the authors:
Alexander V. Dreval — Dr. Sc. (Med.), Professor, Head of the Department of Endocrinology and Digital Medicine, N.A. Semashko National Research Institute of Public Health; 12, build. 1, Vorontsovo Pole, Moscow, 105064, Russian Federation; ORCID iD 0000-0002-3135-9003
Olga A. Nechaeva — C. Sc. (Med.), Associate Professor of the Department of Endocrinology and Digital Medicine, N.A. Semashko National Research Institute of Public Health; 12, build. 1, Vorontsovo Pole, Moscow, 105064, Russian Federation.
Oleg A. Dreval — C. Sc. (Med.), Researcher at the Department of Therapeutic Endocrinology of the Department of General Endocrinology. M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-8944-9837
Timur A. Britvin — Dr. Sc. (Med.), Leading Researcher at the Department of Surgery, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0001-6160-1342
Artur R. Gabrielyan — Professor of the Department of Public Health and Healthcare, N.A. Semashko National Research Institute of Public Health; 12, build. 1, Vorontsovo Pole, Moscow, 105064, Russian Federation.
Contact information: Alexander V. Dreval, e-mail: endocrinolog-cab@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 11.07.2024.
Revised 05.08.2024.
Accepted 28.08.2024.