Введение
Репродуктивная система женщины как любая функциональная система в организме, с биологической точки зрения имеет конкретную цель — воспроизводство потомства и должна активно работать от менархе до менопаузы. Так и было до XXI в., но сегодня мы живем во времена эколого-репродуктивного диссонанса, когда молодая женщина детородного возраста нацелена прежде всего на карьеру и достижение материального благосостояния, что ведет к позднему вступлению в брак и отсроченному материнству. В результате у современной женщины за репродуктивный период наблюдается 400–450 менструальных циклов и овуляций, что не является нормой с биологической точки зрения. Именно поэтому вступление в естественную менопаузу у подавляющего большинства женщин в настоящее время проходит на фоне климактерического синдрома, который проявляется вазомоторными расстройствами, нарушением сна, вульвовагинальной атрофией и развитием генитоуринарного синдрома1.
Возраст наступления менопаузы зависит от ряда факторов, в том числе и от региона проживания [1], в России это возраст от 49 лет до 51 года1. Наступление менопаузы, т. е. прекращение менструаций, свидетельствует о старении не только репродуктивной системы, но и организма в целом, в том числе и иммунной системы. Типичные для пожилого возраста заболевания, такие как аутоиммунные болезни, рак, метаболические и нейродегенеративные заболевания, частые инфекционные процессы различной локализации, связаны с изменением баланса воспалительных и противовоспалительных механизмов иммунной защиты и формированием провоспалительного статуса, определяемого в настоящее время как возрастное воспаление.
В современном мире отмечается отчетливая тенденция к увеличению продолжительности жизни, и, по прогнозам демографов ООН, к 2050 г. каждый пятый человек в мире будет старше 65 лет2. Таким образом, в настоящее время треть своей жизни женщина находится в состоянии менопаузы.
В России в 2022 г. распоряжением Правительства РФ № 4356-р была принята «Национальная стратегия действий в интересах женщины на 2023–2030 годы», которая провозглашает благополучное старение и долголетие женщин национальным приоритетом и регламентирует систему мер по поддержке инноваций в фармакологии и биотехнологиях, направленных на повышение длительности здоровой жизни женщины.
Одним из частых проявлений менопаузальных расстройств является генитоуринарный синдром, тяжесть проявлений которого коррелирует с длительностью менопаузы. Если в перименопаузе от генитоуринарного синдрома страдают 15% женщин, то в постменопаузе его симптомы выявляются у 80% пациенток [2–4]. Нарушения мочеиспускания у женщин при длительности постменопаузы до 5 лет диагностируются в 15,5% наблюдений, при постменопаузе более 20 лет — до 41,4% [5].
Причины рецидивирующих ИМП
Причины возникновения проблем мочеполовой системы связаны со снижением уровня половых стероидов в менопаузе, что приводит к атрофическим изменениям в слизистой влагалища, уретры и мочевого пузыря, так как ткани мочеполового тракта являются эстрогензависимыми. Клинически это проявляется сухостью и зудом, дискомфортными ощущениями во влагалище. Кроме того, на фоне дефицита эстрогенов возникают и анатомические изменения во влагалище, уретре, мочевом пузыре и наружных половых органах [6], способствующие дисбиотическим процессам и ощелачиванию влагалищной среды, что в конечном итоге приводит к различным нарушениям мочеиспускания и развитию инфекционных заболеваний мочевыводящих путей [7].
Инфекции мочевыводящих путей (ИМП) относятся к широко распространенным воспалительным процессам [8].
Особенностью воспалительных процессов мочевого пузыря у женщин старше 50 лет в силу менопаузальных анатомо-функциональных изменений мочевыводящих путей является склонность к хроническому рецидивирующему течению.
Женщины страдают ИМП в 8 раз чаще мужчин [10], а 50–60% взрослых женщин переносят ИМП хотя бы один раз в жизни, что влияет на качество их жизни и психологическое благополучие [10, 11].
В манифестации острого цистита и рецидивирующих форм ИМП важная роль отводится микробиоценозу мочевого пузыря, влагалища и кишечника [12–16].
Современные методы исследования [13] позволили обнаружить микробиом в здоровом урогенитальном тракте и развеяли миф о стерильности мочевыводящих путей. В настоящее время исследования, в том числе на основе биопсии мочевого пузыря, выявили Escherichia coli в эпителиальных клетках мочевого пузыря, что позволило авторам рассматривать его как резервуар, из которого E. coli может выделяться в мочу [12, 17]. Было установлено, что E. coli может не только проникать в клетки мочевого пузыря и размножаться в них, но и образовывать внутриклеточные бактериальные сообщества, которые были обнаружены в отслоившихся уротелиальных клетках [18].
Данные литературы свидетельствуют, что внутриклеточные бактериальные сообщества позволяют патогенам выживать даже после лечения антибиотиками и обусловливать хроническую колонизацию [17, 19]. Это подтверждает тот факт, что в большинстве (82%) случаев обострение цистита вызвано тем же штаммом, что и при предыдущей инфекции, даже при назначении надлежащей антибактериальной терапии [19–25].
Проведенные эпидемиологические, серологические и бактериологические исследования показали, что E. coli является наиболее частым возбудителем ИМП и выделяется у 75–85% больных циститом среди амбулаторных пациентов [25–30].
Таким образом, по мнению большинства исследователей, основными уропатогенами являются грамотрицательные бактерии, в основном E. coli [31, 32]. Однако ряд авторов указывают, что у пожилых людей нередко возбудителями заболевания выступают Enterococcus spp. (11,6%), в то время как в популяции они высеваются всего в 5,3% случаев [33].
Проведенные масштабные исследования показывают, что микробиота кишечника играет ключевую роль в гомеостазе, поддержании здоровья и развитии заболеваний различных органов и систем, в том числе мочеполовой системы [34]. Кроме того, результаты многочисленных исследований последних лет доказали, что микробиомы влагалища и мочевыводящих путей неразрывно связаны и участвуют в поддержании здоровья мочеполовой системы [13]. Установлено, что у женщин с хроническими циститами наблюдается более высокое содержание E. coli в микробиоме влагалища (>105 КОЕ/мл) [35], а стрептококки группы B и G. vaginalis способствуют выживанию E. coli в мочевом пузыре [12, 36, 37]. При этом Gardnerella часто выявляется в образцах мочи здоровых женщин [25]. Так как женщины болеют ИМП чаще, чем мужчины, высказывается предположение, что влагалище является основным источником патогенов, колонизирующих мочевой пузырь [38, 39]. Рецидивирующие циститы строго связаны с дисбактериозом мочевыводящих путей [12, 13].
В настоящее время не вызывает сомнений, что вагинальная микробиота, в которой преобладают лактобациллы, играет важную и, часто, определяющую роль в предотвращении развития ИМП за счет поддержания низкого pH и конкурентного исключения колонизации уропатогенами. В клинических исследованиях была доказана эффективность приема определенных штаммов Lactobacillus для профилактики или лечения ИМП [40, 41].
Современные подходы к лечению ИМП
Основой лечения острого воспалительного процесса являются антибиотики. Однако широкое и не всегда обоснованное использование антибиотиков во всем мире привело к появлению полирезистентных бактерий. Проблема антибиотикорезистентности — одна из самых обсуждаемых в медицине. Еще в конце прошлого века было ясно, что рецидивы ИМП тесно связаны с устойчивостью к антибиотикам [12, 42]. По этим причинам растет интерес к поиску естественных методов профилактики и лечения ИМП, чтобы противостоять растущей бактериальной резистентности к антибиотикам и частым рецидивам. Для предотвращения таких инфекций были исследованы различные альтернативы, такие как антиадгезивные компоненты, пробиотики и пребиотики. Многие исследователи считают использование пробиотиков одним из перспективных направлений в профилактике и лечении ИМП [43, 44].
Согласно современным представлениям в развитии воспалительного процесса в мочевом пузыре выделяют три основных этапа: микробная колонизация, присоединение бактерий к рецепторам уроэпителия и инвазия в клетки мочевыводящих путей. Присоединение патогенов к уроэпителию опосредовано адгезинами, которые распознают поверхностные рецепторы клеток, что позволяет уропатогенам напрямую присоединяться к эпителию мочевого пузыря и противостоять гидродинамическому потоку мочи [45].
Роль полифенолов клюквы в лечении и профилактике ИМП
Среди средств, содержащих натуральные компоненты, широко известны препараты на основе клюквы (Vaccinium macrocarpon). Употребление клюквы рекомендуется для облегчения симптомов цистита, многочисленные эпидемиологические и интервенционные исследования доказали эффективность продуктов из клюквы в профилактике циститов, снижении частоты и тяжести эпизодов ИМП у женщин [46–51].
В качестве возможного механизма, лежащего в основе защитного действия клюквы при циститах, рассматривается способность полифенолов клюквы действовать как антиадгезивные агенты, которые предотвращают прилипание патогенов к рецепторам уроэпителиальных клеток [52, 53]. Многочисленные исследования ex vivo подтвердили антиадгезивную активность образцов мочи, собранных у добровольцев, которые употребляли продукты из клюквы, по сравнению с образцами мочи, собранными в группе плацебо.
Для лечения рецидивирующих ИМП целесообразным является сочетание клюквы с пробиотиками, влияющими на восстановление здорового микробиома и повышающими эффективность терапии [54]. Комбинированное действие клюквы с пробиотиками рассматривается как многообещающая стратегия лечения ИМП. Кроме того, экспериментально при моделировании ИМП у лабораторных мышей был доказан антибактериальный эффект клюквы за счет уникальной смеси органических кислот — хинной, яблочной, шикимовой и лимонной, — обнаруженных в клюкве [55].
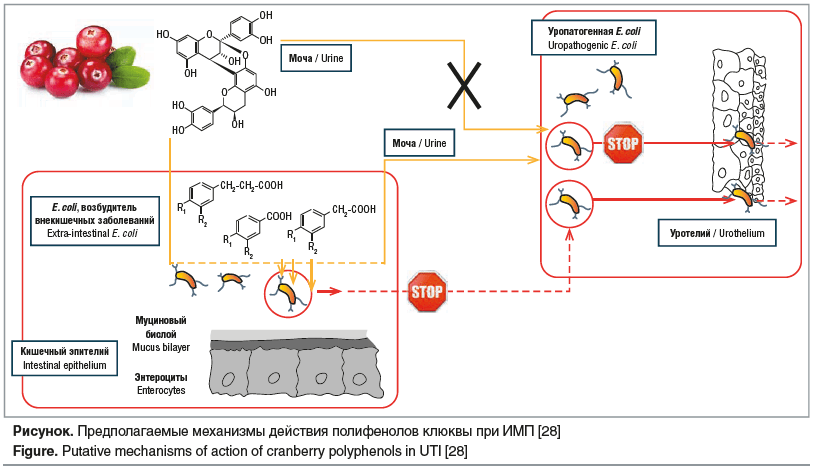
![Рисунок. Предполагаемые механизмы действия полифенолов клюквы при ИМП [28] Figure. Putative mechanisms of action of cranberry polyphenols in UTI [28] Рисунок. Предполагаемые механизмы действия полифенолов клюквы при ИМП [28] Figure. Putative mechanisms of action of cranberry polyphenols in UTI [28]](https://www.rmj.ru/upload/medialibrary/ede/awx47fvtkssi9x0xkh3qjxuctgiup2v4/32-1.png)
Последние годы особое внимание уделяется влиянию на кишечную микробиоту организма проантоцианидинов типа А и их метаболитов, модулирующих ее состав и предотвращающих дисбактериоз [28]. Способность клюквы модулировать микробиоту кишечника основывается на ослаблении влияния животной диеты на ее состав [56]. Исследования in vitro показали, что флавоноиды и фенольные кислоты клюквы могут взаимодействовать с внекишечной E. coli (ExPEC) и уменьшать ее (транзиторную) кишечную колонизацию, а следовательно, снижать риск возникновения ИМП. Потенциальные механизмы действия полифенолов клюквы против ИМП представлены на рисунке [28].
Не только микробиом кишечника участвует в метаболизме полифенолов клюквы, но и соединения клюквы и их микробные метаболиты могут влиять на микробиоту кишечника и обусловливать профилактический эффект относительно колонизации кишечника уропатогенами, что позволяет говорить о двустороннем взаимодействии между полифенолами и микробиотой кишечника.
Другими словами, полезные пребиотические эффекты клюквы, направленные против ИМП, будут модулироваться нашей кишечной микробиотой через ее различную способность метаболизировать флавоноиды и фенольные кислоты клюквы в биоактивные метаболиты. Индивидуальные различия, обнаруженные в профилактических эффектах клюквы против ИМП, могут быть связаны с различиями в составе кишечной микробиоты у разных людей. Соединения, непосредственно отвечающие за многие из известных полезных для здоровья свойств клюквы, остаются не до конца изученными, однако понятно, что это различные метаболиты, компоненты которых оказывают синергический эффект, действуя на разных уровнях и снижая токсичность и побочные эффекты лекарств. В настоящее время характеристика клюквы и исследования отдельных/чистых соединений, фокусирующиеся на синергии между чистыми соединениями, имеют большое значение для понимания их терапевтического эффекта. Показано, что сложные углеводы, в частности ксилоглюкан и пектиновые олигосахариды, являются важными компонентами продуктов из клюквы и новой целью для исследований возможных пребиотических эффектов, которые способствуют биологической активности клюквы [57].
F. Montorsi et al. [54] в пилотном исследовании доказали эффективность комбинированного приема Lactobacillus rhamnosus SGL06, клюквы и витамина C для профилактики рецидивирующих ИМП. Кроме того, была проведена оценка влияния лактобацилл в сочетании с проантоцианидинами (ПАЦ) клюквы типа А на снижение инвазии внекишечных патогенных E. coli (ExPEC) в кишечные клетки [цит. по 28].
Хорошо себя зарекомендовал комплекс натуральных растительных веществ с доказанной эффективностью — D-манноза, экстракт клюквы и витамин С, которые вошли в состав биологически активной добавки (БАД) Цистениум II. Компоненты подобраны так, чтобы действовать синергично на причины развития цистита. Входящий в состав Цистениума II моносахарид D-манноза препятствует адгезии бактерий к уротелию мочевого пузыря за счет увеличения клиренса бактерий с мочой. Экстракт клюквы (ПАЦ клюквы) защищает слизистую мочевого пузыря от бактерий. Цистениум II содержит 72 мг ПАЦ типа А в суточной дозе, это самое большое количество ПАЦ клюквы среди препаратов, доступных в РФ. Кроме антиадгезивного эффекта метаболиты ПАЦ клюквы типа А нормализуют уробиом в постменопаузе за счет пребиотического действия метаболитов клюквы. Витамин С создает среду, непригодную для жизни бактерий. Оба компонента — и D-манноза, и продукты на основе клюквы вошли в Европейские рекомендации урологов 2024 г. для неантибактериальной профилактики циститов в постменопаузе. Только после безуспешности неантибактериальной профилактики переходят к антибактериальной терапии [58].
Препарат безопасен и разрешен к применению даже во время беременности. Клиническое исследование Н.А. Нашивочниковой и соавт. [59] показало высокую (81,9%) эффективность жевательных таблеток Цистениум II у беременных с острым циститом и обострением рецидивирующего цистита.
Таким образом, БАД Цистениум II помимо полифенолов клюквы, содержащая D-маннозу и витамин С, оказывает противомикробное, противовоспалительное, спазмолитическое и диуретическое действие, снижая риск обострений хронического цистита и улучшая функциональное состояние почек и мочевыводящих путей.
Заключение
Таким образом, постменопаузальные циститы являются часто встречаемой патологией в популяции женщин 50 лет и старше. Анатомо-физиологические особенности мочеполового тракта на фоне физиологического снижения уровня эстрогенов способствуют частым рецидивам заболевания, что оказывает значимое влияние на работоспособность и повседневную жизнь женщины, в целом снижая качество жизни. Использование антибиотиков снимает симптомы острого воспалительного процесса, но не оказывает воздействия на основные патогенетические механизмы развития заболевания. Кроме того, системное использование антибиотиков способствует нарушению нормальной микробиоты кишечника, влагалища и мочевого пузыря, приводя к дисбиозу и создавая благоприятные условия для активизации условно-патогенной флоры. Не случайно в настоящее время в научной литературе имеется множество публикаций, посвященных лечению ИМП у женщин с использованием фитопрепаратов, про- и пребиотиков. При этом отмечается их высокая эффективность, сопоставимая с эффективностью антибиотикотерапии. Особое внимание как в отечественных, так и зарубежных публикациях отводится препаратам, содержащим экстракт плодов клюквы (Vaccinium macrocarpon).
1Клинические рекомендации. Менопауза и климактерическое состояние у женщины. 2021 г.
2К 2050 году число пожилых людей превысит число детей в возрасте до 15 лет. (Электронный ресурс. ). URL: https://news.un.org/ru/story/2009/02/1140271 (дата обращения: 15.11.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Селихова Марина Сергеевна — д.м.н., профессор, профессор кафедры акушерства и гинекологии ФГБОУ ВО ВолгГМУ Минздрава России; 400131, Россия, г. Волгоград, пл. Павших Борцов, д. 1; ORCID iD 0000-0002-4393-6111
Бурова Наталья Александровна — д.м.н., доцент, заведующая кафедрой акушерства и гинекологии ФГБОУ ВО ВолгГМУ Минздрава России; 400131, Россия, г. Волгоград, пл. Павших Борцов, д. 1; ORCID iD 0000-0002-0546-8732
Сьянова Ольга Юрьевна — врач акушер-гинеколог и врач ультразвуковой диагностики, медицинский советник компании АО «Аквион»; 123112, Россия, г. Москва, Пресненская наб., д. 8, стр. 1, МФК «Город столиц», Северный блок, башня «Москва»; ORCID iD 0009-0008-7612-8234
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: Сьянова О.Ю. является сотрудником компании АО «Аквион».
Вклад авторов: Селихова О.А., Бурова Н.А. — разработка концепции статьи, сбор данных литературы; оформление и редактирование рукописи, утверждение окончательного варианта статьи; Сьянова О.Ю. — редактирование статьи, анализ литературы и предоставление дополнительных ссылок на литературу.
Статья поступила 29.11.2024.
Поступила после рецензирования 24.12.2024.
Принята в печать 16.01.2025.
ABOUT THE AUTHORS:
Marina S. Selikhova — Dr. Sc. (Med.), Professor, professor of the Department of Obstetrics and Gynecology, Volgograd State Medical University; 1, Pavshikh Bortsov sq., Volgograd, 400131, Russian Federation; ORCID iD 0000-0002-4393-6111
Natalia A. Burova — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology, Volgograd State Medical University; 1, Pavshikh Bortsov sq., Volgograd, 400131, Russian Federation; ORCID iD 0000-0002-0546-8732
Olga Yu. Syanova — obstetrician-gynecologist and ultrasound diagnostics specialist, Medical Adviser of Akvion JSC; 8, build. 1, Northern Block, Tower «Moscow», Presnenskaya Emb., Multifaceted Complex «Gorod Stolits», Moscow, 123112, Russian Federation; ORCID iD 0009-0008-7612-8234
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interest: Olga Yu. Syanova is the employee of Akvion JSC.
Contribution of authors: Selikhova M.S., Burova N.A. — article concept development and literature data preparation and editing; final article version approval; Syanova O.Yu. — editing the article, analyzing the literature and providing additional references to the literature.
Received 29.11.2024.
Revised 24.12.2024.
Accepted 16.01.2025.